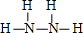题目内容
肼(N2H4)和氧气以及KOH 溶液可组成碱性燃料电池,产物为氮气和水,它是一种高效低污染的新型电池.下列关于肼燃料电池的说法不正确的是( )
分析:肼、氧气和氢氧化钾构成燃料电池,负极上肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极上氧气得电子和水反应生成氢氧根离子,正极反应为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2+2H2O,放电时原电池中阴离子向负极移动,根据电解质溶液的变化来分析溶液pH的变化.
解答:解:A.该燃料电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,故A正确;
B.正极上氧气得电子发生还原反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C.该燃料电池放电时,电解质溶液中氢氧根离子向负极移动,故C错误;
D.该电池反应式为N2H4+O2=N2+2H2O,放电过程中生成水,氢氧化钾物质的量不变,溶液体积增大,则氢氧化钾浓度减小,溶液的pH减小,故D正确;
故选C.
B.正极上氧气得电子发生还原反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C.该燃料电池放电时,电解质溶液中氢氧根离子向负极移动,故C错误;
D.该电池反应式为N2H4+O2=N2+2H2O,放电过程中生成水,氢氧化钾物质的量不变,溶液体积增大,则氢氧化钾浓度减小,溶液的pH减小,故D正确;
故选C.
点评:本题考查了原电池原理,正确书写正负极上电极反应式是解本题关键,再结合离子的移动方向、电解质溶液的变化来分析解答即可,难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目