题目内容
【题目】实验室使用标签如图1所示的盐酸来配制470mL1.2mol/L的稀盐酸.回答下列问题. 
(1)需要的仪器有:烧杯、量筒、、玻璃棒、 .
(2)实验步骤如下: ①计算:该盐酸的物质的量浓度为 , 取用时应取用mL.
②量取:用合适的量筒量取盐酸.
③稀释:取烧杯,用少量水将盐酸稀释,冷却至室温.
④转移、洗涤、定容、摇匀.
⑤装瓶、贴上标签.
(3)若加蒸馏水过程中不慎超过了刻度线,则应 .
(4)若某同学观察液面的情况如图2所示,则他所配制好的溶液浓度(选填:偏大,偏小或无影响).
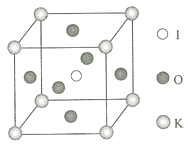
(5)用该盐酸来分析20mL某碳酸钠溶液时,反应图象如图3所示,则该碳酸钠溶液的物质的量浓度是 .
【答案】
(1)500 mL容量瓶;胶头滴管
(2)12 mol/L;50.0
(3)重新配制溶液
(4)偏大
(5)0.6 mol/L
【解析】解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、容量瓶,配制配制470mL1.2mol/L的稀盐酸,应选择500mL容量瓶,所以还缺少的仪器:500 mL容量瓶 胶头滴管;
所以答案是:500 mL容量瓶 胶头滴管;(2)浓盐酸的物质的量浓度C= ![]() =12mol/L;配制470mL1.2mol/L的稀盐酸,应选择500mL容量瓶,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:12mol/L×V=500mL×1.2mol/L,解得V=50.0mL;
=12mol/L;配制470mL1.2mol/L的稀盐酸,应选择500mL容量瓶,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:12mol/L×V=500mL×1.2mol/L,解得V=50.0mL;
所以答案是:12 mol/L;50.0;(3)若加蒸馏水过程中不慎超过了刻度线,导致实验失败,且无法补救,应重新配制;
所以答案是:重新配制溶液;(4)图为俯视刻度线,导致溶液体积偏小,依据C= ![]() 可知,溶液浓度偏大;
可知,溶液浓度偏大;
所以答案是:偏大;(5)依据图象可知,前10mL盐酸与碳酸钠反应生成碳酸氢钠,10﹣20mL盐酸与碳酸氢钠反应生成二氧化碳,依据Na2CO3~NaHCO3~HCl可知,n(Na2CO3)=1.2mol/L×0.01L=0.012mol,则碳酸钠的物质的量浓度C= ![]() =0.6 mol/L;
=0.6 mol/L;
所以答案是:0.6 mol/L.
【考点精析】关于本题考查的配制一定物质的量浓度的溶液,需要了解配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线才能得出正确答案.

【题目】为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器都正确的是( )
选项 | 不纯物质 | 除杂试剂 | 分离方法 | 必用仪器 |
A | 碘水 | 四氯化碳 | 萃取 | 分液漏斗 |
B | 氯化钾(氯化钙) | 适量盐酸 | 过滤 | 玻璃棒 |
C | 硝酸铜(硝酸银) | 适量铜粉 | 结晶 | 酒精灯 |
D | 硫酸钾(碳酸钾) | 适量盐酸 | 蒸馏 | 温度计 |
A. A B. B C. C D. D