题目内容
关于下列四个图象的说法中正确的是( )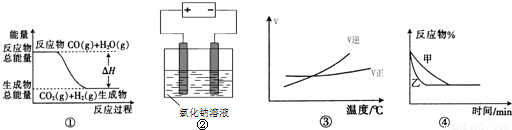
A.图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
B.图②表示电解氯化钠的稀溶液,阴、阳两极产生气体体积之比可能是1:1
C.图③表示可逆反应:A2(g)+3B2(g)?2AB3(g)△H>0
D.图④表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大
【答案】分析:A.根据反应物的总能量和生成物的总能量的相对大小来判断该反应是吸热还是放热反应;
B.氯气在水中的溶解度比氢气的大;
C.升高温度平衡向吸热方向进行;
D.根据先到达平衡的反应,压强大,在根据平衡移动原理,判断平衡是否移动.
解答:解:A.因反应物的总能量>生成物的总能量,根据能量守恒原理,该反应为放热,△H<0,故A正确;
B.阴极:2H++2e-═H2↑,阳极:2Cl--2e-═Cl2↑,但氯气在水中的溶解度比氢气的大,故B错误;
C.升高温度平衡向吸热方向进行,该反应正反应吸热,升高温度平衡向正反应方向进行,图中交点后V逆>V正,故C错误;
D.因乙先到达平衡,故乙的压强大,甲的压强小,但增大压强,平衡向正反应方向移动,而图象中平衡未发生移动,乙应是加入催化剂的原因,故D错误.
故选A.
点评:本题主要考查了化学反应类型(吸热还是放热)的判断,氯气与氢气溶解度的大小,温度与压强对化学反应速率和平衡的影响.
B.氯气在水中的溶解度比氢气的大;
C.升高温度平衡向吸热方向进行;
D.根据先到达平衡的反应,压强大,在根据平衡移动原理,判断平衡是否移动.
解答:解:A.因反应物的总能量>生成物的总能量,根据能量守恒原理,该反应为放热,△H<0,故A正确;
B.阴极:2H++2e-═H2↑,阳极:2Cl--2e-═Cl2↑,但氯气在水中的溶解度比氢气的大,故B错误;
C.升高温度平衡向吸热方向进行,该反应正反应吸热,升高温度平衡向正反应方向进行,图中交点后V逆>V正,故C错误;
D.因乙先到达平衡,故乙的压强大,甲的压强小,但增大压强,平衡向正反应方向移动,而图象中平衡未发生移动,乙应是加入催化剂的原因,故D错误.
故选A.
点评:本题主要考查了化学反应类型(吸热还是放热)的判断,氯气与氢气溶解度的大小,温度与压强对化学反应速率和平衡的影响.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目




