题目内容
【题目】(1)常温下,将pH=10和pH=12的NaOH溶液以1∶1的体积比混合,则混合后所得溶液的pH约为________。
(2)0.2 mol·L-1 NaHSO4和0.1 mol·L-1 BaCl2溶液按等体积混合后,则溶液的pH等于________。
(3)用pH=4和pH=11的强酸和强碱混合,使pH=10,则两溶液的体积比为________。
【答案】(1)11.7(2)1(3)9∶2
【解析】欲求混合后溶液的pH,应先判断混合后溶液的酸碱性。若呈碱性,应先求溶液中c(OH-),再求c(H+),而后计算pH;若呈酸性,可直接求出混合后c(H+),再计算pH。由题意可得:
(1)c(OH-)=![]() =
=![]() ≈5×10-3
≈5×10-3
c(H+)·c(OH-)=KW=1×10-14
c(H+)=![]() =2×10-12
=2×10-12
pH=-lgc(H+)=-lg(2×10-12)=12-0.3=11.7
(2)NaHSO4为强电解质
c(H+)=![]() =0.1(mol·L-1)
=0.1(mol·L-1)
pH=-lgc(H+)=1
(3)混合后溶液呈碱性,则
10-4=![]()
整理可得:2×10-4V(酸)=9×10-4V(碱)
所以,![]() =
=![]()

【题目】正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.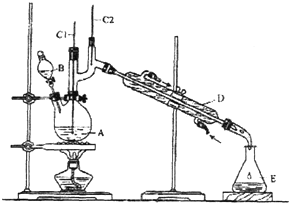
发生的反应如下:
CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90﹣95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75﹣77℃馏分,产量2.0g.回答下列问题:
(1)上述装置图中,B仪器的名称是 , D仪器的名称是;
(2)加入沸石的作用是;
(3)分液漏斗使用前必须进行的操作是 (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”)
(5)反应温度应保持在90﹣95℃.其原因是
(6)本实验中,正丁醛的产率为 %.