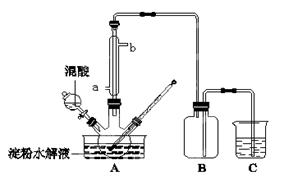
题目内容
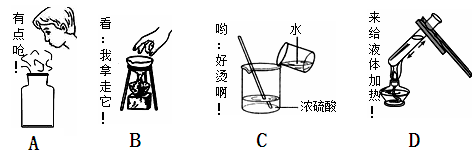
下列实验操作能达到实验目的的是:
| 选项 | 实验操作 | 实验目的 |
| A | 滴加KMnO4(H+)溶液,充分振荡 | 确定苯中混有己烯 |
| B | 向水解后的蔗糖溶液中直接加入新制的Cu(OH)2并加热 | 确定蔗糖是否发生水解 |
| C | 加入金属钠 | 确定酒精中混有醋酸 |
| D | 加淀粉 | 确定KCl中含有KI |
A
B不正确,应该先加入氢氧化钠溶液中和催化剂硫酸。乙醇和钠反应也生成氢气,C不正确。淀粉和碘单质才能发生显色反应,与碘化钾不反应,D不正确。答案选A。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目