题目内容
(10分)短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C—比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)C―的结构示意图为 ;
与C同族的上一周期元素的气态氢化物的稳定性比HC的________(填“强”或“弱”);
与C同族的上一周期元素的气态氢化物的沸点比HC的________(填“高”或“低”);
(2)元素D的最高价氧化物的电子式为_______,D的气态氢化物的二氯代物有_____种结构。
(3)工业上冶炼单质A的化学方程式为_____________________________________;
(4)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材料是_______(用化学式填写),负极电极反应是___________________________________。
(1) 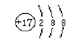 ,
强, 高; (2)
,
强, 高; (2)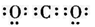 , 1; (每空1分)
, 1; (每空1分)
(3)MgCl2(熔融) Mg+
Cl2↑(2分)
Mg+
Cl2↑(2分)
(4)Mg (1分), Al-3e- + 4OH- = AlO2- + 2H2O(2分)
【解析】0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,说明A属于第ⅢA,氧化物是AO。0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,所以氧化物的相对分子质量是0.4÷0.01=40,则A的蒸质量数是24。A原子核内质子数目与中子数目相等,所以A的原子序数是12,即A是镁元素。B元素原子核外第三层电子数目比第一层多1个,则B是Al。C—比A元素的离子多1个电子层,因此C是氯元素。D元素的原子核外第二层比第一层多2个电子。则D是碳元素。
(1)同主族自上而下非金属性逐渐增强,氢化物的稳定性也是逐渐增强的。HF中含有氢键,所以沸点高于氯化氢的。
(2)CO2中碳和氧形成的是双键,电子数为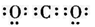 ,甲烷是正四面体型结构,其二卤代物没有同分异构体。
,甲烷是正四面体型结构,其二卤代物没有同分异构体。
(3)镁是活泼的金属,通过电解熔融放热氯化镁得到金属镁。
(4)原电池较活泼的金属作负极,失去电子。虽然镁比铝活泼,但铝可以和氢氧化钠反应生成氢气,所以作负极的是铝。镁是正极。负极反应式为Al-3e- + 4OH- = AlO2- + 2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

 ___________________________
___________________________