��Ŀ����
����Ŀ���¹���ѧ�ҹ�����1902�꿪ʼ�о��ɵ���������ֱ�Ӻϳɰ����ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ��䷴Ӧԭ��Ϊ�� N2(g)+3H2(g)![]() 2NH3(g) ��H=��92.4kJ��mol��1
2NH3(g) ��H=��92.4kJ��mol��1
һ��������Ȼ���ϳɰ��ļ����������£�
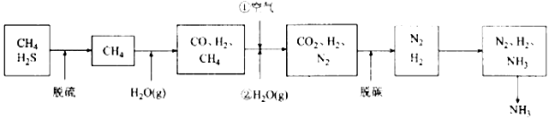
��Ȼ���Ⱦ�����Ȼ��ͨ������ת�����پ���������̼�ѳ��ȹ��õ��������������백�ϳ������Ƶò�Ʒ����
��1��������߰����ʵĽǶȣ����ϳ��������˵����������� ��
��2��CH4��ˮ�����������ķ�ӦΪCH4(g)+ H2O (g)![]() CO (g) +3H2(g)����2 L���ܱ������У������ʵ�����1 mol��CH4��H2O (g)��Ϸ�Ӧ��CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CO (g) +3H2(g)����2 L���ܱ������У������ʵ�����1 mol��CH4��H2O (g)��Ϸ�Ӧ��CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
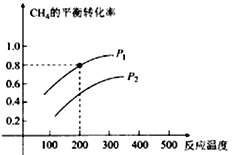
�ٸ÷�Ӧ����H 0�����������
��ͼ��ѹǿP1 P2�����������
��200��ʱ�÷�Ӧ��ƽ�ⳣ��K= ������һλС������
��3��NH3��������������NO����NOΪԭ��ͨ�����ķ��������Ʊ�NH4NO3�����ܷ�Ӧ��8NO+7H2O ![]() 3NH4NO3+2HNO3����д���Զ��Բ������缫��������Ӧʽ�� ��������Ӧʽ�� ������������Ҫ����һ�����ʲ���ʹ������ȫ��ת��ΪNH4NO3���������� ��
3NH4NO3+2HNO3����д���Զ��Բ������缫��������Ӧʽ�� ��������Ӧʽ�� ������������Ҫ����һ�����ʲ���ʹ������ȫ��ת��ΪNH4NO3���������� ��
���𰸡���1�����¡���ѹ��2���٣��ڣ���K=69.1��mol��L��1��2
��3��������3NO+15e-+18H+=3NH4++3H2O
������5NO��15e-+10H2O=5NO3-+20H+����ˮ����
��������
�����������1����Ϊ�ϳɰ��ķ�ӦΪ�����С�ķ��ȷ�Ӧ��Ϊ��߰���������ƽ�������ƶ������ϳ��������˵�������������������ѹ��
��2������ͼ��֪��ѹǿ���䣬�¶�Խ��CH4��g����ת����Խ���¶�����ƽ��������Ӧ�����ƶ��������¶�ƽ�������ȷ�Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ������H��0�� ���¶��ݻ����䣬����ѹǿƽ���������С�ķ����ƶ����淴Ӧ�����ƶ�����CH4��g����ת����ԽС������ѹǿԽ��CH4��g����ת����ԽС����P1��P2����200�棬CH4��g����ת����0.8�����Բμӷ�Ӧ��CH4��g�������ʵ���Ϊ0.8mol��
CH4��g��+H2O��g���TCO��g��+3H2��g��
��ʼŨ����mol/L����0.5 0.5 0 0
ת��Ũ����mol/L����0.4 0.4 0.4 1.2
ƽ��Ũ����mol/L����0.1 0.1 0.4 1.2
����200��ʱ�÷�Ӧ��ƽ�ⳣ��K= c(CO)c3(H2)/ c(CH4)c(H2O) =(0.4��1.23)/(0.1��0.1)=69.1��mol��L��1��2��
��3�����NO�Ʊ�NH4NO3������������ԭ��Ӧ���缫��ӦʽΪ3NO + 15e-+ 18H+ = 3NH4+ + 3H2O����������������Ӧ���缫��ӦʽΪ5NO��15e- + 10H2O = 5NO3-+20 H+����������Ӧ�ɿ�����Ҫʹ��ʧ�����غ㣬����������NO3-�����ʵ�����������������NH4+�����ʵ������ܷ�Ӧ����ʽΪ8NO+7H2O ![]() 3NH4NO3+2HNO3�������Ҫʹ������ȫ��ת��ΪNH4NO3���貹��������ˮ��
3NH4NO3+2HNO3�������Ҫʹ������ȫ��ת��ΪNH4NO3���貹��������ˮ��
