题目内容
有关物质有如图所示的转化关系.C为黄绿色气体单质,F的焰色反应为紫色;G为紫黑色晶体单质.实验室常用固体E在B的催化下加热制取气体单质H.

(1)D的化学式为
(2)E的名称是
(3)反应①的离子方程式为
(4)写出③的化学方程式
(5)并写出另外一种实验室制取H的化学方程式
(6)写出反应②的离子反应方程式

(1)D的化学式为
KI
KI
(2)E的名称是
氯酸钾
氯酸钾
(3)反应①的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
(4)写出③的化学方程式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
| ||
| △ |
(5)并写出另外一种实验室制取H的化学方程式
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
(6)写出反应②的离子反应方程式
6I-+ClO3-+6H+═3I2+Cl-+3H2O
6I-+ClO3-+6H+═3I2+Cl-+3H2O
.分析:C为黄绿色气体单质,则C是Cl2,实验室用浓盐酸和二氧化锰制取Cl2,则A是HCl,B是MnO2,F的焰色反应为紫色,则F中含有钾元素;G为紫黑色晶体单质,则G是I2,根据元素守恒知,D是KI,氯气和碘化钾发生置换反应生成氯化钾和碘,则F是KCl;
实验室常用固体E在二氧化锰的催化下加热制取气体单质H,且同时生成KCl,则该反应是实验室用KClO3加热制取氧气的反应原理,则H是O2,E是KClO3,结合物质的性质分析解答.
实验室常用固体E在二氧化锰的催化下加热制取气体单质H,且同时生成KCl,则该反应是实验室用KClO3加热制取氧气的反应原理,则H是O2,E是KClO3,结合物质的性质分析解答.
解答:解:C为黄绿色气体单质,则C是Cl2,实验室用浓盐酸和二氧化锰制取Cl2,则A是HCl,B是MnO2,F的焰色反应为紫色,则F中含有钾元素;G为紫黑色晶体单质,则G是I2,根据元素守恒知,D是KI,氯气和碘化钾发生置换反应生成氯化钾和碘,则F是KCl;
实验室常用固体E在二氧化锰的催化下加热制取气体单质H,且同时生成KCl,则该反应是实验室用KClO3加热制取氧气的反应原理,则H是O2,E是KClO3,
(1)通过以上分析知,D是KI,故答案为:KI;
(2)通过以上分析知,E是KClO3,其名称是氯酸钾,故答案为:氯酸钾;
(3)在加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,离子反应方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(4)在二氧化锰作催化剂、加热条件下,氯酸钾分解生成氧气,反应方程式为:2KClO3
2KCl+3O2↑,
故答案为:2KClO3
2KCl+3O2↑;
(5)实验室还可以用过氧化钠和水反应制取氧气,反应方程式为:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(6)碘化钾、盐酸和氯酸钾能发生氧化还原反应生成碘单质,该反应的离子方程式为:6I-+ClO3-+6H+═3I2+Cl-+3H2O,故答案为:6I-+ClO3-+6H+═3I2+Cl-+3H2O.
实验室常用固体E在二氧化锰的催化下加热制取气体单质H,且同时生成KCl,则该反应是实验室用KClO3加热制取氧气的反应原理,则H是O2,E是KClO3,
(1)通过以上分析知,D是KI,故答案为:KI;
(2)通过以上分析知,E是KClO3,其名称是氯酸钾,故答案为:氯酸钾;
(3)在加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,离子反应方程式为:MnO2+4H++2Cl-
| ||
| ||
(4)在二氧化锰作催化剂、加热条件下,氯酸钾分解生成氧气,反应方程式为:2KClO3
| ||
| △ |
故答案为:2KClO3
| ||
| △ |
(5)实验室还可以用过氧化钠和水反应制取氧气,反应方程式为:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(6)碘化钾、盐酸和氯酸钾能发生氧化还原反应生成碘单质,该反应的离子方程式为:6I-+ClO3-+6H+═3I2+Cl-+3H2O,故答案为:6I-+ClO3-+6H+═3I2+Cl-+3H2O.
点评:本题以氯气、氧气的实验室制取原理为载体考查了无机物的推断,以“黄绿色气体”为突破口采用正向推导的方法进行推断,明确物质的性质及物质之间的转化是解本题关键,并会书写物质之间发生反应的化学方程式或离子方程式,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.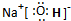
 A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法正确的是( )
