题目内容
t ℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)  2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)________。
E.相同时间内消耗2n mol SO2的同时生成n mol O2
(3)t2℃时,若将物质的量之比n(SO2)∶n(O2)=1∶1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
 2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:(1)从反应开始到化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)________。
| A.容器内压强不再发生变化 |
| B.SO2的体积分数不再发生变化 |
| C.容器内气体原子总数不再发生变化 |
| D.相同时间内消耗2n mol SO2的同时消耗n mol O2 |
(3)t2℃时,若将物质的量之比n(SO2)∶n(O2)=1∶1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
(1)0.1 mol·L-1·min-1 20%
(2)ABE
(3)80%
(2)ABE
(3)80%
(1) 2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
起始浓度/(mol·L-1) 1 0.5 0
转化浓度/(mol·L-1) 0.2 0.1 0.2
平衡浓度/(mol·L-1) 0.8 0.4 0.2
v(SO3)=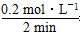 =0.1 mol·L-1·min-1
=0.1 mol·L-1·min-1
α(SO2)=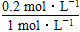 ×100%=20%。
×100%=20%。
(3)设SO2、O2的物质的量均为1 mol,反应过程中总物质的量减小了2 mol×20%=0.4 mol。
由SO2+O2 2SO3 Δn
2SO3 Δn
2 1 2 1
知当总物质的量减少0.4 mol时,SO2反应了0.8 mol,SO2的转化率为80%。
 2SO3(g)
2SO3(g)起始浓度/(mol·L-1) 1 0.5 0
转化浓度/(mol·L-1) 0.2 0.1 0.2
平衡浓度/(mol·L-1) 0.8 0.4 0.2
v(SO3)=
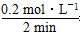 =0.1 mol·L-1·min-1
=0.1 mol·L-1·min-1α(SO2)=
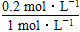 ×100%=20%。
×100%=20%。(3)设SO2、O2的物质的量均为1 mol,反应过程中总物质的量减小了2 mol×20%=0.4 mol。
由SO2+O2
 2SO3 Δn
2SO3 Δn2 1 2 1
知当总物质的量减少0.4 mol时,SO2反应了0.8 mol,SO2的转化率为80%。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( ) cC(g);5min时,测得C为xmol。下列说法中一定正确的是( )
cC(g);5min时,测得C为xmol。下列说法中一定正确的是( ) 2C(g)+D(g) 。现将5molA和10molB加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示。
2C(g)+D(g) 。现将5molA和10molB加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示。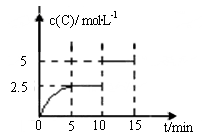
 C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是( )
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是( ) 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( )
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是( )