题目内容
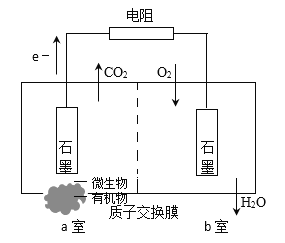
【题目】某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:

下列有关三种金属的说法中正确的是( )
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
【答案】D
【解析】
A. 由现象可以看出反应最快的是镁,其次是钛,无明显现象的是铜;根据反应快慢、能否与酸反应和活动性之间的对应关系可以得出,三种金属活动性顺序为镁、钛、铜,故A错误;
B.钛和镁都与盐酸反应,在除去镁的同时,钛也被除掉了,故B错误;
C. 钛是一种比较昂贵的金属,用钛从硫酸铜溶液中置换出铜,成本太高,在工业上是不可取的,故C错误;
D. 活泼性强的金属能把活泼性弱的金属从其盐溶液中置换出来,镁比铜活泼,所以铜不能置换镁,故D正确;
答案选D。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g) ![]() N2(g)+CO2(g),测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g),测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
容器(温度) | 0min | 40min | 80min | 120min | 160min | |
甲(400℃) | c(NO) | 2.00 mol/ L | 1.50 mol/ L | 1.10 mol/ L | 0.80 mol/ L | 0.80 mol/ L |
乙(400℃) | c(NO) | 1.00 mol/ L | 0.80 mol/ L | 0.65 mol/ L | 0.53 mol/ L | 0.45 mol/ L |
丙(T℃) | c(NO) | 2.00 mol/ L | 1.40 mol/ L | 1.10 mol/ L | 1.10 mol/ L | 1.10 mol/ L |
A.达到平衡状态时,2v正(NO)= v逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为v(NO) >0.01125 mol·L-1·min-1
D.由表格数据可知:T<400℃