题目内容
常温下,在10 L容器中通入A mol氢气和B mol氧气(A、B均为小于或等于4的正整数),点燃后充分反应,恢复到常温,容器内的气体(水蒸气的体积忽略不计)密度(g/L)最大值可能是( )
A.6.4 B.9. 6 C.11.2 D.12.8
A.6.4 B.9. 6 C.11.2 D.12.8
C
因为密度=气体质量/气体体积,而气体体积恒为10 L,所以所剩的氧气(摩尔质量比氢气大)越多,则最后气体的密度也越大,因此,反应前氧气应尽可能多;氢气则尽可能少,据题意可知,此时氧气的物质的量应为4 mol,氢气的物质的量应为1 mol,则有:
2H2 + O2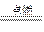 2H2O
2H2O
2 1
1 mol 0.5 mol
故,反应后剩余氧气的物质的量为
4 mol-0.5 mol="3.5" mol
此时容器内的气体密度为: ="11.2" g·L-1,应选C。
="11.2" g·L-1,应选C。
2H2 + O2
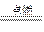 2H2O
2H2O2 1
1 mol 0.5 mol
故,反应后剩余氧气的物质的量为
4 mol-0.5 mol="3.5" mol
此时容器内的气体密度为:
 ="11.2" g·L-1,应选C。
="11.2" g·L-1,应选C。
练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目






 ×6.02×1023
×6.02×1023