题目内容
工业生产硅(粗)的主要原理为:SiO2+2C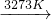 Si(粗)+2CO↑.
Si(粗)+2CO↑.
(1)在制硅(粗)的过程中同时会有碳化硅生成,若产物硅和碳化硅的物质的量之比为1:1,则参加反应的C 和SiO2的质量比为______.
(2)工业上可通过以下步骤实现硅(粗)高度纯化:
Si(粗)+2Cl2(g)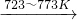 SiCl4(l);SiCl4+2H2
SiCl4(l);SiCl4+2H2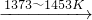 Si(纯)+4HCl
Si(纯)+4HCl
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂多少吨?
(3)工业上还可以通过如下图所示的流程制取纯硅:
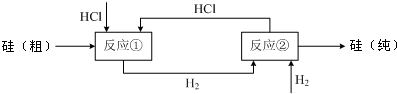
反应①:Si(粗)+3HCl(g)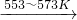 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2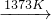 Si(纯)+3HCl
Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%.设损失的HCl、H2不能参与循环,则在下一轮次的生产中,需补充投入HCl和H2的物质的量之比是多少?______.
解:(1)设硅、碳化硅的物质的量都是xmol,根据方程式知,根据反应SiO2+2C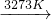 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑,
SiC+2CO↑,
x 2x x x 3x x
生成xmol硅、xmol碳化硅需要的二氧化硅的物质的量是xmol+xmol=2xmol、碳的物质的量是2x+3x=5xmol,
所以参加反应的 C 和 SiO2 的质量比=(5x×12)g:(2x×60)g=1:2,
故答案为:1:2;
(2)设需要生产25.2吨纯硅需纯度为75%石英砂m吨,则:
SiO2 ~SiCl4 ~Si(纯)
60 28
m吨×75%×(1-10%)×80%×80% 25.2吨
所以m吨×75%×(1-10%)×80%×80%:25.2吨=60:28
解得m=125t
答:生产25.2吨纯硅需纯度为75%石英砂125吨;
(3)由工艺流程与反应①、反应②可知,补充的HCl等于损失的HCl、补充的氢气等于损失的氢气,制备1mol纯硅需要1mol粗硅,由反应①可知需要HCl物质的量为3mol,故实际通入的HCl为 ,补充的HCl为
,补充的HCl为 -3mol=1mol,
-3mol=1mol,
由反应②可知,需要氢气的物质的量为1mol,实际通入氢气为mol,补充的氢气为 -1mol=0.25mol,故需补充投入HCl和H2的物质的量之比是1:0.25=4:1,
-1mol=0.25mol,故需补充投入HCl和H2的物质的量之比是1:0.25=4:1,
故答案为:4:1.
分析:(1)根据反应SiO2+2C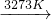 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑及硅和碳化硅的物质的量之比为1:1,计算出参加反应的C 和SiO2的质量比;
SiC+2CO↑及硅和碳化硅的物质的量之比为1:1,计算出参加反应的C 和SiO2的质量比;
(2)根据石英砂和硅之间关系式进行计算;
(3)由工艺流程与反应①、反应②可知,补充的HCl等于损失的HCl、补充的氢气等于损失的氢气,分别计算出损失的氯化氢和氢气的物质的量即可.
点评:本题考查物质的量的有关计算,明确物质之间的关系是解本题关键,本题难度不大.
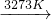 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑,
SiC+2CO↑,x 2x x x 3x x
生成xmol硅、xmol碳化硅需要的二氧化硅的物质的量是xmol+xmol=2xmol、碳的物质的量是2x+3x=5xmol,
所以参加反应的 C 和 SiO2 的质量比=(5x×12)g:(2x×60)g=1:2,
故答案为:1:2;
(2)设需要生产25.2吨纯硅需纯度为75%石英砂m吨,则:
SiO2 ~SiCl4 ~Si(纯)
60 28
m吨×75%×(1-10%)×80%×80% 25.2吨
所以m吨×75%×(1-10%)×80%×80%:25.2吨=60:28
解得m=125t
答:生产25.2吨纯硅需纯度为75%石英砂125吨;
(3)由工艺流程与反应①、反应②可知,补充的HCl等于损失的HCl、补充的氢气等于损失的氢气,制备1mol纯硅需要1mol粗硅,由反应①可知需要HCl物质的量为3mol,故实际通入的HCl为
 ,补充的HCl为
,补充的HCl为 -3mol=1mol,
-3mol=1mol,由反应②可知,需要氢气的物质的量为1mol,实际通入氢气为mol,补充的氢气为
 -1mol=0.25mol,故需补充投入HCl和H2的物质的量之比是1:0.25=4:1,
-1mol=0.25mol,故需补充投入HCl和H2的物质的量之比是1:0.25=4:1,故答案为:4:1.
分析:(1)根据反应SiO2+2C
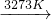 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑及硅和碳化硅的物质的量之比为1:1,计算出参加反应的C 和SiO2的质量比;
SiC+2CO↑及硅和碳化硅的物质的量之比为1:1,计算出参加反应的C 和SiO2的质量比;(2)根据石英砂和硅之间关系式进行计算;
(3)由工艺流程与反应①、反应②可知,补充的HCl等于损失的HCl、补充的氢气等于损失的氢气,分别计算出损失的氯化氢和氢气的物质的量即可.
点评:本题考查物质的量的有关计算,明确物质之间的关系是解本题关键,本题难度不大.

练习册系列答案
相关题目

