题目内容
(12分)几种短周期元素的原子半径及某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
化合价 |
–1 |
–2 |
+4、–4 |
+4、–2 |
+5、–3 |
+3 |
+2 |
+1 |
|
原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期 族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)
(3)J单质在B单质中燃烧可生成化合物X,X的电子式是 ,其中所含的化学键类型为 。
(4)I单质可在D的最高价氧化物中燃烧,涉及的化学方程式为: 。
(5)B与H所形成的化合物与J的最高价氧化物对应水化物Y的溶液发生反应的离子方程式为 。
(1) 三 ⅥA(各1分) (2) F-> Na+ > Al3+(2分)
(3) 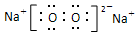 (2分)
离子键,非极性键(2分)
(2分)
离子键,非极性键(2分)
(4) 2Mg + CO2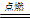 2MgO + C(2分)
(5) Al2O3 + 2OH-= 2AlO2-+ H2O(2分)
2MgO + C(2分)
(5) Al2O3 + 2OH-= 2AlO2-+ H2O(2分)
【解析】考查元素周期律的应用。根据元素的主要化合价和原子半径可知,A~J分别是F、O、C、S、P、Al、Mg、Na。
(1)硫元素位于第三周期第ⅥA。
(2)A、H、J对应的离子的核外电子排布相同,其离子半径随原子序数的增大而减小,所以离子半径大小顺序是F-> Na+ > Al3+。
(3)钠在氧气中燃烧生成物是过氧化钠,属于离子化合物,含有离子键和非极性键。
(4)镁可以在CO2中燃烧,生成氧化镁和碳,反应式为2Mg + CO2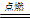 2MgO + C。
2MgO + C。
(5)氧化铝是两性氧化物既能溶于酸生成盐和水,也能溶于强碱生成盐和水,反应式为Al2O3 + 2OH-= 2AlO2-+ H2O。
