题目内容
【题目】现有如下两个个反应:
a.3Cu+8H++2NO3- =3Cu2+ +4H2O+2NO↑
b.Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O
(1)反应____(填字母)不能设计成原电池,原因是__________。
(2)上述反应能设计成原电池的,请画出简单原电池实验装置图_________,注明电极材料和电解质溶液,并写出正极电极反应反应式_____。
(3)上题所设计原电池的电解质溶液内大量存在的离子中向负极迁移的是_______,电池工作一段时间后,电解质溶液质量改变了3.3g,负极减少质量_________g。
【答案】b b不是氧化还原反应 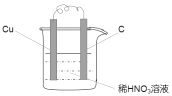 4H++NO3- +3e-=2H2O+NO↑ NO3- 4.8
4H++NO3- +3e-=2H2O+NO↑ NO3- 4.8
【解析】
(1)要设计成原电池,该反应必须有电子的转移,是自发的氧化还原反应;
(2)反应3Cu+8H++2NO3- =3Cu2+ +4H2O+2NO↑中,Cu被氧化,应为原电池负极,电解质溶液为稀硝酸,硝酸根离子被还原生成NO,为正极反应,以此解答。
(3)根据原电池的工作原理和差量法作答。
(1)反应b是复分解反应,不是自发的氧化还原反应,故不能设计成原电池,
故答案为:b;b不是氧化还原反应;
(2)利用反应3Cu+8H++2NO3- =3Cu2+ +4H2O+2NO↑设计原电池时,根据反应可知,Cu为负极,则正极可以是活泼性不如Cu的金属,也可以是碳棒,电解质溶液应为稀HNO3,实验装置图为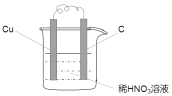 ,正极硝酸根离子得电子被还原成NO,发生还原反应,其电极反应式为:4H++NO3- +3e-=2H2O+NO↑,
,正极硝酸根离子得电子被还原成NO,发生还原反应,其电极反应式为:4H++NO3- +3e-=2H2O+NO↑,
故答案为: ;4H++NO3- +3e-=2H2O+NO↑;
;4H++NO3- +3e-=2H2O+NO↑;
(3)向负极迁移的是溶液中的阴离子NO3-,负极反应为3Cu- 6e-= 3Cu2+,理论上3mol铜参与反应同时产生了2molNO,溶液质量增加3×64g-2×30g=132g,设负极质量减少x,则
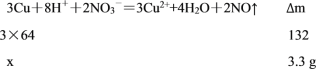 ,则
,则![]() ,则x=4.8g,
,则x=4.8g,
故答案为:NO3-;4.8。

 金钥匙试卷系列答案
金钥匙试卷系列答案
