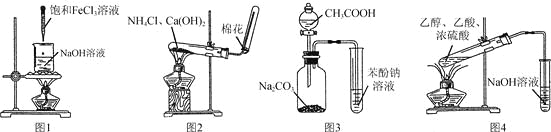
ЬтФПФкШн
ЁОЬтФПЁПгаСђЫсгыЯѕЫсЕФЛьКЯвКЃЌШЁГіЦфжа10mLЃЌМгШызуСПЕФBaCl2ШмвКЃЌНЋЩњГЩЕФГСЕэЙ§ТЫЯДЕгЃЌИЩдяГЦЕУжЪСПЮЊ4.66gЁЃСэШЁетжжШмвК10mLгы2molЁЄL-1ЕФNaOHШмвК25mLЧЁКУжаКЭЁЃдђЃК
(1)ЛьКЯвКжаc(H2SO4)=__molЁЄL-1ЃЌc(HNO3)=__molЁЄL-1
(2)СэШЁ10mLЕФЛьКЯвК(ЛьКЯвКжаЕФЯѕЫсЪгЮЊЯЁЯѕЫс)гы0.96gЭЗлЙВШШЪБЃЌВњЩњЦјЬхЕФЬхЛ§ЮЊ__L(БъзМзДПі)ЁЃ
ЁОД№АИЁП2 1 0.224
ЁОНтЮіЁП
(1)гЩЬтвтжЊСђЫсБЕЕФЮяжЪЕФСП:n(BaSO4)=n(H2SO 4)=![]() =0.02molЃЌ ШмвКжаЕФH+гыNaOHЗДгІЃЌn(NaOH)=n(H+)=0.025LЁС2mol/L=0.05molЃЌn(HNO3)=0.05molЃ2 n(H2SO4)== 0.01molЃЌc(H2SO4)=
=0.02molЃЌ ШмвКжаЕФH+гыNaOHЗДгІЃЌn(NaOH)=n(H+)=0.025LЁС2mol/L=0.05molЃЌn(HNO3)=0.05molЃ2 n(H2SO4)== 0.01molЃЌc(H2SO4)=![]() =
=![]() =2 mol/LЃЌc(HNO3) =
=2 mol/LЃЌc(HNO3) =![]() =
=![]() =1moL/LЃЛ
=1moL/LЃЛ
(2)ШмвКжаЕФn(H+)= 0.05molЃЌn(HNO3)=0.01molЃЌn(Cu)=0.015molЃЌгЩЛЏбЇЗДгІ3Cu+8H++2NO3-=3Cu2++2NOЁќ+4H2OПЩвдЭЦжЊЃЌгы0.015molЕФCuЗДгІашвЊЕФH +ЕФЮяжЪЕФСПЮЊ0.04mol<0. 05molЃЌЭЌРэЗДгІЕєЕФNO3-ЕФЮяжЪЕФСПЮЊ0.01molЃЌЫљвдH+Й§СПЃЌCuШЋВПШмНтЃЌЩњГЩЕФNOЕФЬхЛ§гІОнCuЕФЮяжЪЕФСПРДМЦЫуЃЌМДn(NO)=2/3ЁС0.015=0.01molЃЌЫљвдV(NO)=0.224LЁЃ

 ЗЂЩЂЫМЮЌаТПЮЬУЯЕСаД№АИ
ЗЂЩЂЫМЮЌаТПЮЬУЯЕСаД№АИЁОЬтФПЁПвбжЊ2A(g)ЃЋB(g)![]() 2C(g)ЁЁІЄHЃНЃa kJЁЄmolЃ1(a>0)ЃЌдквЛИігаДпЛЏМСЕФЙЬЖЈШнЛ§ЕФШнЦїжаМгШы2 mol AКЭ1 mol BЃЌдк500 ЁцЪБГфЗжЗДгІДяЦНКтКѓЃЌCЕФХЈЖШЮЊІи molЁЄLЃ1ЃЌЗХГіЕФШШСПЮЊb kJЁЃ
2C(g)ЁЁІЄHЃНЃa kJЁЄmolЃ1(a>0)ЃЌдквЛИігаДпЛЏМСЕФЙЬЖЈШнЛ§ЕФШнЦїжаМгШы2 mol AКЭ1 mol BЃЌдк500 ЁцЪБГфЗжЗДгІДяЦНКтКѓЃЌCЕФХЈЖШЮЊІи molЁЄLЃ1ЃЌЗХГіЕФШШСПЮЊb kJЁЃ
(1)вбжЊЃКA(g)ЃЋX(g)![]() 2B(g)ЁЁІЄHЃНЃ133.2 kJЁЄmolЃ1ЃЛ5A(g)ЃЋX(g)
2B(g)ЁЁІЄHЃНЃ133.2 kJЁЄmolЃ1ЃЛ5A(g)ЃЋX(g)![]() 4C(g)ЁЁІЄHЃНЃ650.4 kJЁЄmolЃ1ЁЃдђaЃН________ЁЃ
4C(g)ЁЁІЄHЃНЃ650.4 kJЁЄmolЃ1ЁЃдђaЃН________ЁЃ
(2)ВЛЭЌЮТЖШЯТИУЗДгІЕФЦНКтГЃЪ§ШчБэЫљЪОЁЃ
гЩДЫПЩЭЦжЊЃЌБэжаT1________T2(ЬюЁА>ЁБЁАЃНЁБЛђЁА<ЁБ)ЁЃ
T/K | T1 | T2 | T3 |
K | 1.00ЁС107 | 2.45ЁС105 | 1.88ЁС103 |
ШєдкдРДЕФШнЦїжаЃЌжЛМгШы2 mol CЃЌ500 ЁцЪБГфЗжЗДгІДяЦНКтКѓЃЌЮќЪеШШСПЮЊc kJЃЌCЕФХЈЖШ_________Іи molЁЄLЃ1(ЬюЁА>ЁБЁАЃНЁБЛђЁА<ЁБ)ЃЌaЁЂbЁЂcжЎМфЕФЙиЯЕЮЊ________ЁЃ
(3)дкЯрЭЌЬѕМўЯТвЊЯыЕУЕН2a kJШШСПЃЌМгШыИїЮяжЪЕФЮяжЪЕФСППЩФмЪЧ________(ЬюађКХ)ЁЃ
AЃЎ4 mol AКЭ2 mol B
BЃЎ4 mol AЁЂ2 mol BКЭ2 mol C
CЃЎ4 mol AКЭ4 mol B
DЃЎ6 mol AКЭ4 mol B
(4)ШєНЋЩЯЪіШнЦїИФЮЊКубЙШнЦї(ЗДгІЧАЬхЛ§ЯрЭЌ)ЃЌЦ№ЪМЪБМгШы2 mol AКЭ1 mol BЃЌ500 ЁцЪБГфЗжЗДгІДяЦНКтКѓЃЌЗХГіЕФШШСПЮЊd kJЃЌдђd________b(ЬюЁА>ЁБЁАЃНЁБЛђЁА<ЁБ)ЁЃ
(5)дквЛЖЈЮТЖШЯТЃЌЯђвЛИіШнЛ§ПЩБфЕФШнЦїжаЃЌЭЈШы3 mol AКЭ2 mol BМАЙЬЬхДпЛЏМСЃЌГфЗжЗДгІЃЌЦНКтЪБШнЦїФкЦјЬхЮяжЪЕФСПЮЊЦ№ЪМЪБЕФ90%ЁЃБЃГжЭЌвЛЗДгІЮТЖШЃЌдкЯрЭЌШнЦїжаЃЌНЋЦ№ЪМЮяжЪЕФСПИФЮЊ4 mol AЁЂ3 mol BКЭ2 mol CЃЌдђЦНКтЪБAЕФАйЗжКЌСП________(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)