题目内容
【题目】关于如图所示装置的叙述,错误的是( )

A. 锌是负极,其质量逐渐减小B. 氢离子在铜表面被还原,产生气泡
C. 电子从锌片经硫酸溶液流向铜片D. 电子从锌片经导线流向铜片
【答案】C
【解析】
依据原电池工作原理进行分析,活泼金属作负极,负极上失去电子,另一极为正极,正极上得到电子,发生还原反应,电子从负极流向正极等等;
A、该装置为原电池装置,锌比铜活泼,即锌作负极,铜作正极,负极反应式为Zn-2e-=Zn2+,其质量逐渐减小,故A说法正确;
B、根据原电池的工作原理,阳离子向正极移动,即H+在铜电极上得电子,被还原,电极反应式为2H++2e-=H2↑,故B说法正确;
C、电子从负极经外电路流向正极,电解质溶液中只有阴阳阳离子的移动,故C说法错误;
D、根据选项C的分析,电子从锌极经导线流向铜片,故D说法正确;
答案选C。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案【题目】如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是
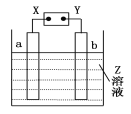
a极板 | b极板 | X电极 | Z | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A. A B. B C. C D. D
【题目】一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g)其中容器Ⅰ中5min时到达平衡。
COCl2(g)其中容器Ⅰ中5min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5min的中反应速率v(CO)=0.16mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55mol
D. 若起始时间容器Ⅰ中加入CO0.8mol、Cl20.8mol,达到平衡时CO的转化率大80%


