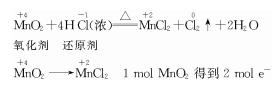题目内容
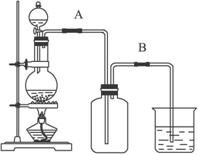
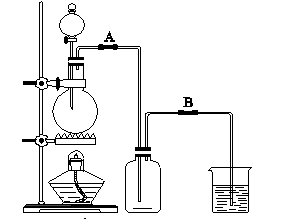
 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图1所示:
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图1所示:(1)写出该反应的化学方程式:
上述反应中,氧化剂是
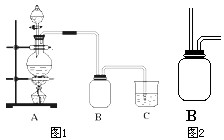
(2)请画出装置图2-B中集气瓶内导管部分.
(3)该兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为合理的是
A、氢氧化钠溶液 B、碳酸钠稀溶液 C、浓硫酸 D、饱和食盐水.
分析:(1)根据浓盐酸和二氧化锰的性质判断生成物,从而写出反应方程式;根据氧化还原反应中得失电子情况判断氧化剂还原剂,再根据物质的量计算反应电子转移;(2)氯气是比空气重的气体,依据装置图分析可知用向上排空气法收集氯气,导气管长进短处;
(3)根据氯气的化学性质判断.
(3)根据氯气的化学性质判断.
解答:解:(1)浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,其反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
该反应中化合价的变化为:MnO2→MnCl2 ,锰元素由+4价→+2价,1mol二氧化锰得2mol电子做氧化剂;HCl→Cl↑,氯元素由-1价→0价,1molHCl失去1mol电子做还原剂,所以其最小公倍数为2反应过程中,1mol氧化剂反应电子转移2mol;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,MnO2,2;
(2)氯气是比空气重的气体,可溶于水,依据装置图分析,导气管长进短处,装置图为: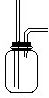 ;
;
故答案为:
(3)氯气和水反应生成盐酸和次氯酸,盐酸和次氯酸具有酸性,盐酸是强酸,能和碱或弱酸盐反应,碳酸钠的浓溶液可以吸收氯气,稀溶液不可以完全吸收,氯气不与浓硫酸、氯化钠反应,则不能用来吸收残余氯气;
故答案为:A.
| ||
该反应中化合价的变化为:MnO2→MnCl2 ,锰元素由+4价→+2价,1mol二氧化锰得2mol电子做氧化剂;HCl→Cl↑,氯元素由-1价→0价,1molHCl失去1mol电子做还原剂,所以其最小公倍数为2反应过程中,1mol氧化剂反应电子转移2mol;
故答案为:MnO2+4HCl(浓)
| ||
(2)氯气是比空气重的气体,可溶于水,依据装置图分析,导气管长进短处,装置图为:
 ;
;故答案为:

(3)氯气和水反应生成盐酸和次氯酸,盐酸和次氯酸具有酸性,盐酸是强酸,能和碱或弱酸盐反应,碳酸钠的浓溶液可以吸收氯气,稀溶液不可以完全吸收,氯气不与浓硫酸、氯化钠反应,则不能用来吸收残余氯气;
故答案为:A.
点评:本题考查了实验室制备氯气的方法和装置分析判断,题目较简单;主要注意以下几点:
1、实验装置中,仪器的连接顺序是实验发生装置→除杂装置→性质检验装置→尾气处理装置;
2、浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;
3、次氯酸是弱酸,但次氯酸具有强氧化性.
1、实验装置中,仪器的连接顺序是实验发生装置→除杂装置→性质检验装置→尾气处理装置;
2、浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;
3、次氯酸是弱酸,但次氯酸具有强氧化性.

练习册系列答案
相关题目
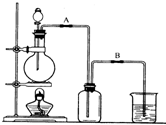 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下:
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下: