题目内容
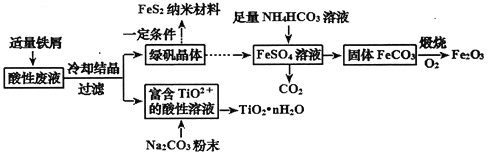
【题目】利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、SO42-等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
(1)TiO2+中钛元素的化合价为________价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式_________________________________。
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释__________________________________。
(3)NH4HCO3溶液与FeSO4溶液反应的离子方程式为_______________________,该反应需控制温度在308K以下,其目的是_____________________________。
(4)已知298K时,Ksp[Fe(OH)2]=8.0×10-16,若在生成的FeCO3达到沉淀溶解平衡时,测得溶液的pH为8.5,c(Fe2+)=1.0×10-5mol·L-1,则所得的FeCO3中________Fe(OH)2(填“有”或“没有”)。
(5)FeS2纳米材料可用于制造高容量锂电池,已知电解质为熔融的K2S,电池放电时的总反应为:4Li+FeS2=Fe+2Li2S,则正极的电极反应式是_______________。
【答案】+4 TiO2++(n+1)H2O![]() TiO2nH2O+2H+ 碳酸钠消耗H+,c(H+)减小,使TiO2+水解平衡向生成TiO2nH2O方向移动 Fe2++2HCO3- =FeCO3↓+CO2↑+H2O 防止NH4HCO3受热分解和减少Fe2+的水解 没有 FeS2+4e-﹦Fe+2S2-
TiO2nH2O+2H+ 碳酸钠消耗H+,c(H+)减小,使TiO2+水解平衡向生成TiO2nH2O方向移动 Fe2++2HCO3- =FeCO3↓+CO2↑+H2O 防止NH4HCO3受热分解和减少Fe2+的水解 没有 FeS2+4e-﹦Fe+2S2-
【解析】
酸性废液(含TiO2+、Fe2+、Fe3+、SO42-等)中加入适量铁屑,发生反应2Fe3++Fe==3Fe2+,冷却结晶后,Fe2+转化为绿矾晶体;绿矾晶体溶于水得FeSO4溶液,往溶液中加入足量的NH4HCO3溶液,发生反应生成CO2气体和FeCO3沉淀等;FeCO3固体在O2中煅烧,可生成Fe2O3和CO2;富含TiO2+的酸性溶液中加入Na2CO3粉末,能得到固体TiO2·nH2O,同时应生成CO2。
(1)TiO2+中,O元素显-2价,则钛元素的化合价为+4价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,表明TiO2+结合H2O中的O,生成H+,则水解的离子方程式为TiO2++(n+1)H2O![]() TiO2nH2O+2H+。答案为:+4;TiO2++(n+1)H2O
TiO2nH2O+2H+。答案为:+4;TiO2++(n+1)H2O![]() TiO2nH2O+2H+;
TiO2nH2O+2H+;
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O,同时应生成CO2气体。用化学反应原理解释为碳酸钠消耗H+,c(H+)减小,使TiO2+水解平衡向生成TiO2nH2O方向移动。答案为:碳酸钠消耗H+,c(H+)减小,使TiO2+水解平衡向生成TiO2nH2O方向移动;
(3)NH4HCO3溶液与FeSO4溶液反应,生成CO2气体和FeCO3沉淀等,离子方程式为Fe2++2HCO3- =FeCO3↓+CO2↑+H2O,该反应需控制温度在308K以下,主要从NH4HCO3的热稳定性和Fe2+的水解两方面考虑,其目的是防止NH4HCO3受热分解和减少Fe2+的水解。答案为:Fe2++2HCO3- =FeCO3↓+CO2↑+H2O;防止NH4HCO3受热分解和减少Fe2+的水解;
(4)溶液的pH为8.5,则pOH=5.5,c(OH-)=1.0×10-5.5mol·L-1,c(Fe2+)=1.0×10-5mol·L-1,则c(Fe2+) c2(OH-)=1.0×10-5×(1.0×10-5.5)2=1.0×10-16<8.0×10-16,故所得的FeCO3中没有Fe(OH)2。答案为:没有;
(5)电解质为熔融的K2S,由电池放电时的总反应:4Li+FeS2=Fe+2Li2S,可确定正极反应为FeS2得电子生成Fe和S2-,电极反应式是FeS2+4e-﹦Fe+2S2-。答案为:FeS2+4e-﹦Fe+2S2-。

【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |