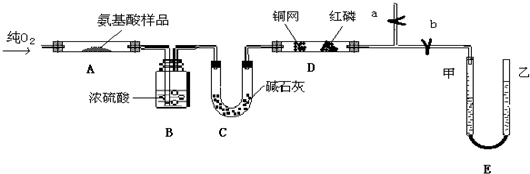
题目内容
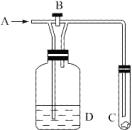
 如图所示,A处通入未经干燥的Cl2,关闭B阀时,C处的红布条看 不 到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中装的是( )
如图所示,A处通入未经干燥的Cl2,关闭B阀时,C处的红布条看 不 到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中装的是( )A、浓硫酸有吸水性,能吸收潮湿氯气中的水分而干燥潮湿的氯气,所以D中装有浓硫酸符合题意,故正确.
B、饱和食盐水能抑制氯气的吸收,但饱和食盐水中有水,不能吸收氯气中的水蒸气,所以D中装有饱和氯化钠溶液不符合题意,故错误.
C、稀盐酸含有水,不能吸收氯气中的水蒸气,所以D中装有稀盐酸不符合题意,故错误.
D、水不能吸收水蒸气,所以D中装有水不符合题意,故错误.
故选A.

 口算能手系列答案
口算能手系列答案(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。

①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)

①你认为t3时改变的条件是 (填写“加压”或“减压”),B的起始物质的量为 mol;
②各阶段平衡时对应的平衡常数如下表所示:
|
时间段 |
t1~t2 |
t2~t3 |
t3~t4 |
t5~t6 |
|
平衡常数 |
K1 |
K2 |
K3 |
K4 |
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系 写此条件下该反应的热化学方程式 ________________
(3)工业上一般采用CO(g) + 2H2(g)  CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为 ,此时的温度 250℃(填“>”、“<”、“=”)
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是: