��Ŀ����
����Ŀ����ͼ��� 
��1������bԪ�ص�ԭ�ӽṹʾ��ͼ �� ��д��Ԫ��b�ĵ����ڶ�����̼��ȼ�յĻ�ѧ����ʽ��
��2����a��b��c����Ԫ�ص�����������Ӧ��ˮ���������ǿ������������д���ʻ�ѧʽ��
��3��д��Ԫ��c����������Ԫ��a������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ��
��4����e��f������������Ӧ��ˮ�������Խ�ǿ���ǣ�����д���ʻ�ѧʽ��
��5��д��dԪ�ص��⻯�һ�����ӹ�������ԭ�ӣ�����ʽ�� �� д��fԪ�ص�������⻯�ﷴӦ�����ӷ���ʽ�� ��
���𰸡�
��1��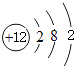 ��2Mg+CO2
��2Mg+CO2 ![]() 2MgO+C
2MgO+C
��2��NaOH��Mg��OH��2��Al��OH��3
��3��Al2O3+2OH��=2AlO2��+H2O
��4��HClO4
��5��![]() ��Cl2+H2O=H++Cl��+HClO
��Cl2+H2O=H++Cl��+HClO
���������⣺��Ԫ�������ڱ���λ�ã���֪aΪNa��bΪMg��cΪAl��dΪO��eΪS��fΪCl����1��Mgԭ�Ӻ��������Ϊ12��ԭ�ӽṹʾ��ͼΪ 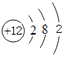 ��þ�ڶ�����̼��ȼ����������þ��̼����ѧ��Ӧ����ʽΪ��2Mg+CO2
��þ�ڶ�����̼��ȼ����������þ��̼����ѧ��Ӧ����ʽΪ��2Mg+CO2 ![]() 2MgO+C��
2MgO+C��
���Դ��ǣ� 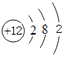 ��2Mg+CO2
��2Mg+CO2 ![]() 2MgO+C����2��������Na��Mg��Al��������Խǿ������������Ӧˮ����ļ���Խǿ���ʼ��ԣ�NaOH��Mg��OH��2��Al��OH��3 ��
2MgO+C����2��������Na��Mg��Al��������Խǿ������������Ӧˮ����ļ���Խǿ���ʼ��ԣ�NaOH��Mg��OH��2��Al��OH��3 ��
���Դ��ǣ�NaOH��Mg��OH��2��Al��OH��3����3��Ԫ��c��������ΪAl2O3 �� Ԫ��a������������Ӧ��ˮ����ΪNaOH�����߷�Ӧ����ƫ��������ˮ����Ӧ���ӷ���ʽΪ��Al2O3+2OH��=2AlO2��+H2O��
���Դ��ǣ�Al2O3+2OH��=2AlO2��+H2O����4�����ڷǽ�����Cl��S������ۺ���������ԣ�HClO4��H2SO4 ��
���Դ��ǣ�HClO4����5��һ�����ӹ�������ԭ�ӵ�dԪ���⻯��ΪH2O������ʽΪ ![]() ��������ˮ��Ӧ����HCl��HClO����Ӧ���ӷ���ʽΪ��Cl2+H2O=H++Cl��+HClO��
��������ˮ��Ӧ����HCl��HClO����Ӧ���ӷ���ʽΪ��Cl2+H2O=H++Cl��+HClO��
���Դ��ǣ� ![]() ��Cl2+H2O=H++Cl��+HClO��
��Cl2+H2O=H++Cl��+HClO��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�