题目内容
1.06g某有机物A完全燃烧后,得到1.792 L CO2气体(标况)和0.9gH2O,该有机物对氢气相对密度是53。(第(1)1分(2)(3)各2分共5分)
(1)求该有机物的相对分子质量。
(2)求该有机物的分子式
(3)根据下述实验现象及结论是,确定该有机物的结构简式
①它不能与溴发生反应
②它能使KMnO4酸性溶液褪色
③它能发生硝化反应,当引入1个硝基时,只能得到1种硝基化合物。
(1)求该有机物的相对分子质量。
(2)求该有机物的分子式
(3)根据下述实验现象及结论是,确定该有机物的结构简式
①它不能与溴发生反应
②它能使KMnO4酸性溶液褪色
③它能发生硝化反应,当引入1个硝基时,只能得到1种硝基化合物。

(1)相对分子质量=该有机物对氢气相对密度*氢气相对分子质量
=53*2
=106
(2)1.06g某有机物A的物质的量n(A)=1.06g/106g·mol-1
=0.01mol
n(C)=1.792l/22.4L·mol-1
=0.08mol
n(H)=2*0.9g/18g·mol-1
=0.1mol
n(O)=(1.06g-0.08mol*12g·mol-1-0.1mol*1g·mol-1)/16g·mol-1
=0
所以A分子中C原子为0.08mol/0.01mol=8
A分子中H原子为0.1mol/0.01mol=10
该有机物的分子式C8H10
(3)由化学式可得该化合物的缺氢指4,可能为含苯环的化合物,由题意,滿足条件的是对二甲苯。

练习册系列答案
相关题目
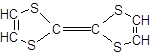
 的有机化合物:
的有机化合物: