题目内容
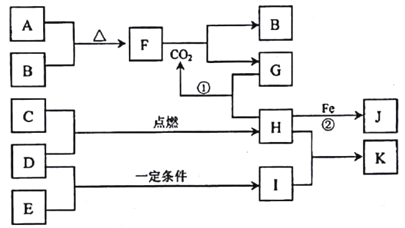
【题目】下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化台物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。
请按要求回答下列问题。
(l)写出下列物质的化学式:D________、F_______________。
(2)反应①的离子方程式为_____________。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为__________。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色,该反应的离子方程式为_________。这说明单质C的氧化性_______于单质碘(填“强”或“弱”)。
(5)向J溶液中滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由灰白色变成红褐色的化学方程式:______________。
【答案】 H2 Na2O2 2H++CO32-=H2O+CO2↑ 产生白色沉淀 Cl2+2I-=I2+2Cl- 强 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】A、B、C、D、E都是短周期元素的单质,C为黄绿色气体,则C为Cl2,化合物H和I两种气体相遇时产生白烟,则D为H2,H为HCl,E为N2,I为NH3,生成K为NH4Cl,反应②为Fe与盐酸反应,则J为FeCl2,化合物G的焰色反应为黄色,与盐酸反应生成CO2,则G为Na2CO3或NaHCO3,A是固体,其余都是气体,结合元素守恒及转化关系可知,A为Na,B为O2,A、B反应生成F,则F为Na2O2,由F与二氧化碳的反应确定G只能为Na2CO3,则
(1)由上述分析可知D为H2,F为Na2O2;(2)反应①为盐酸与碳酸钠的反应,该离子反应为2H++CO32-=H2O+CO2↑;(3)K为NH4Cl,加入硝酸酸化的硝酸银溶液有氯化银沉淀生成,实验现象是出现白色沉淀;(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色,是因氯气氧化碘离子生成碘单质,离子反应为Cl2+2I-=I2+2Cl-,则氯气的氧化性强于碘的氧化性;(5)J为FeCl2,滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,发生4Fe(OH)2+O2+2H2O=4Fe(OH)3。