ΧβΡΩΡΎ»ί
Μν–‘ZnO‘ΎœπΫΚΓΔΥήΝœΓΔΆΩΝœΙΛ“Β÷–”–÷Ί“Σ”Π”ΟΘ§“Μ÷÷”…¥÷ZnO(Κ§FeOΓΔCuO)÷Τ±ΗΜν–‘ZnOΒΡΝς≥Χ»γœ¬(“―÷ΣΘΚΦν ΫΧΦΥα–ΩΨ≠±Κ…’Ω…÷ΤΒΟΜν–‘ZnO)ΘΚ

“―÷ΣΘΚΦΗ÷÷άκΉ”…ζ≥…«β―θΜ·Έο≥ΝΒμ ±ΒΡpH»γ±μΘΚ

«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)≤Ϋ÷ηAΦ”H2O2ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ « Θ§ΗΟ≤Ϋ÷η–ηΩΊ÷Τ»ή“ΚpHΒΡΖΕΈß « ΓΘ
(2)A»ή“Κ÷–÷ς“ΣΚ§”–ΒΡ»ή÷ « ΓΘ
(3)Φν ΫΧΦΥα–ΩΨ≠±Κ…’÷ΤΒΟΜν–‘ZnOΒΡΖ¥”ΠΠΛHΘΨ0Θ§ΗΟΖ¥”ΠΡήΉ‘ΖΔΫχ––ΒΡ‘≠“ρ «ΠΛS (―ΓΧνΓΑ=Γ±ΓΔΓΑΘΨΓ±ΜρΓΑΘΦΓ±)0ΓΘ
(4)»τΨ≠¥ΠάμΚσΒΡΖœΥ°pH=8Θ§¥Υ ±Zn2+ΒΡ≈®Ε»ΈΣ mg/L(≥ΘΈ¬œ¬Θ§KspΘέZn(OH)2Θί=1.2ΓΝ10-17)ΓΘ
(1)2Fe2++H2O2+2H+=2Fe3++2H2O 3.2ΓΪ5.2 (2)(NH4)2SO4 (3)ΘΨ (4)0.78
ΓΨΫβΈωΓΩ(1)≤Ϋ÷ηAΦ”»κH2O2ΒΡΡΩΒΡ «ΫΪFe2+―θΜ·ΈΣFe3+±ψ”Ύ≥ΐ»ΞΘ§Ά§ ±≤Μ“ΐ»κ–¬ΒΡ‘”÷ ΓΘ”…Νς≥ΧΆΦΩ¥≥ωΗΟ≤Ϋ≤ΌΉς÷Μ…ζ≥…Fe(OH)3≥ΝΒμΘ§ΫαΚœ±μ÷– ΐΨίΩ…÷Σ–ηΩΊ÷Τ»ή“ΚpHΈΣ3.2ΓΪ5.2÷°ΦδΓΘ
(2)ΝρΥα–Ω»ή“Κ÷–Φ”»κΧΦΥα«βοßΚσ…ζ≥…Φν ΫΧΦΥα–Ω≥ΝΒμΚΆΝρΥαοßΓΘ
(3)Ζ¥”ΠΉ‘ΖΔΘ§«“ΠΛHΘΨ0,‘ρΠΛS±Ί¥σ”Ύ0ΓΘ
(4)”…c(Zn2+)ΓΝc2(OH-)=Ksp
c(Zn2+)=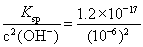 =1.2ΓΝ10-5 (molΓΛL-1),Φ¥1.2ΓΝ10-5 molΓΛL-1ΓΝ65 gΓΛmol-1=7.8ΓΝ10-4 gΓΛL-1,Φ¥0.78 mgΓΛL-1
=1.2ΓΝ10-5 (molΓΛL-1),Φ¥1.2ΓΝ10-5 molΓΛL-1ΓΝ65 gΓΛmol-1=7.8ΓΝ10-4 gΓΛL-1,Φ¥0.78 mgΓΛL-1

 ΩΎΥψ–ΡΥψΥΌΥψ”Π”ΟΧβœΒΝ–¥πΑΗ
ΩΎΥψ–ΡΥψΥΌΥψ”Π”ΟΧβœΒΝ–¥πΑΗ Ά§≤ΫΆΊ’Ι‘ΡΕΝœΒΝ–¥πΑΗ
Ά§≤ΫΆΊ’Ι‘ΡΕΝœΒΝ–¥πΑΗ“‘œ¬ «25Γφ ±ΦΗ÷÷Ρ―»ήΒγΫβ÷ ΒΡ»ήΫβΕ»ΘΚ
Ρ―»ίΒγΫβ÷ | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
»ήΫβΕ»/g | 9ΓΝ10-4 | 1.7ΓΝ10-6 | 1.5ΓΝ10-4 | 3.0ΓΝ10-9 |
‘ΎΈόΜζΜ·ΚœΈοΒΡΧα¥Ω÷–Θ§≥Θάϊ”ΟΡ―»ήΒγΫβ÷ ΒΡ»ήΫβΤΫΚβ‘≠άμ≥ΐ»ΞΡ≥–©άκΉ”ΓΘάΐ»γΘΚ
ΔΌΈΣΝΥ≥ΐ»Ξ¬»Μ·οß÷–ΒΡ‘”÷ Fe3ΘΪΘ§œ»ΫΪΜλΚœΈο»ή”ΎΥ°Θ§Φ”»κ“ΜΕ®ΝΩΒΡ ‘ΦΝΖ¥”ΠΘ§Ιΐ¬ΥΚσΫαΨßΓΘ
ΔΎΈΣΝΥ≥ΐ»Ξ¬»Μ·ΟΨΨßΧε÷–ΒΡ‘”÷ Fe3ΘΪΘ§œ»ΫΪΜλΚœΈο»ή”ΎΥ°Θ§Φ”»κΉψΝΩΒΡMg(OH)2Θ§≥δΖ÷Ζ¥”ΠΘ§Ιΐ¬ΥΚσΫαΨßΓΘ
ΔέΈΣΝΥ≥ΐ»ΞΝρΥαΆ≠ΨßΧε÷–ΒΡ‘”÷ Fe2ΘΪΘ§œ»ΫΪΜλΚœΈο»ή”ΎΥ°Θ§Φ”»κ“ΜΕ®ΝΩΒΡH2O2Θ§ΫΪFe2ΘΪ―θΜ·≥…Fe3ΘΪΘ§ΒςΫΎ»ή“ΚΒΡpHΘΫ4Θ§Ιΐ¬ΥΚσΫαΨßΓΘ
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)…œ ω»ΐ÷÷≥ΐ‘”ΖΫΑΗΕΦΡήΙΜ¥οΒΫΚήΚΟΒΡ–ßΙϊΘ§Fe2ΘΪΓΔFe3ΘΪΕΦ±ΜΉΣΜ·ΈΣ Εχ≥ΐ»ΞΓΘ
(2)ΔΌ÷–Φ”»κΒΡ ‘ΦΝ”ΠΗΟ―Γ‘ώ ΈΣ“ΥΓΘ
(3)ΔΎ÷–≥ΐ»ΞFe3ΘΪΥυΖΔ…ζΒΡΉήΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ ΓΘ
(4)œ¬Ν–”κΖΫΑΗΔέœύΙΊΒΡ–π ω÷–Θ§’ΐ»ΖΒΡ « (ΧνΉ÷ΡΗ)ΓΘ
AΘ°H2O2 «¬Χ…Ϊ―θΜ·ΦΝΘ§‘Ύ―θΜ·Ιΐ≥Χ÷–≤Μ“ΐΫχ‘”÷ ΓΔ≤Μ≤ζ…ζΈέ»Ψ
BΘ°ΫΪFe2ΘΪ―θΜ·ΈΣFe3ΘΪΒΡ÷ς“Σ‘≠“ρ «Fe(OH)2≥ΝΒμ±»Fe(OH)3≥ΝΒμΫœΡ―Ιΐ¬Υ
CΘ°ΒςΫΎ»ή“ΚpHΘΫ4Ω…―Γ‘ώΒΡ ‘ΦΝ ««β―θΜ·Ά≠ΜρΦν ΫΧΦΥαΆ≠
DΘ°Cu2+Ω…“‘¥σΝΩ¥φ‘Ύ”ΎpHΘΫ4ΒΡ»ή“Κ÷–
EΘ°‘ΎpHΘΨ4ΒΡ»ή“Κ÷–Fe3ΘΪ“ΜΕ®≤ΜΡή¥σΝΩ¥φ‘Ύ



