题目内容
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)。___________
Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(5)反应③中氧化产物与还原产物的物质的量之比为_________。
【答案】147 33.6 H2SO4(浓) CuSO4 0.5mol 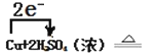 CuSO4+2H2O+SO2↑ 5:1
CuSO4+2H2O+SO2↑ 5:1
【解析】
(1)根据反应①Fe+H2SO4(稀)=FeSO4+H2↑可知每转移3mol电子,消耗硫酸3/2mol,生成氢气3/2mol;
(2)②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑,根据氧化剂降得还,还原剂升失氧判断;
CuSO4+2H2O+SO2↑,根据氧化剂降得还,还原剂升失氧判断;
(3)根据②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑,可以看出1molSO2生成,被还原硫酸1mol;
CuSO4+2H2O+SO2↑,可以看出1molSO2生成,被还原硫酸1mol;
(4)单线桥法表示箭头是还原剂指向氧化剂,写出转移电子数;
(5)根据还原剂升失氧,对应氧化产物;氧化剂降得还,对应还原产物,进行分析。
(1)Fe+H2SO4(稀)=FeSO4+H2↑,当反应①转移3摩尔电子时,消耗H2SO4的质量是3/2mol×98g/mol= 147g,产生氢气的体积(标准状况)3/2mol×22.4L/mol=33.6L;
答案:147 33.6
(2)Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑,氧化剂化合价降低,所以浓硫酸为氧化剂,还原剂升失氧,对应氧化产物,硫酸铜为氧化产物;
CuSO4+2H2O+SO2↑,氧化剂化合价降低,所以浓硫酸为氧化剂,还原剂升失氧,对应氧化产物,硫酸铜为氧化产物;
答案:H2SO4(浓) CuSO4
(3)1mol SO2生成,就有1mol硫酸被还原,当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是![]() =0.5mol;
=0.5mol;
答案:0.5mol
(4)箭头还原剂指向氧化剂,注明转移电子数: 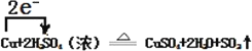 ;
;
答案:
(5)反应③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中氧化产物与还原产物均为氯气,根据还原剂升失氧,可知有5molCl-生成氯气,因此氧化产物为5/2mol,氧化剂降得还,1mol+5价氯生成氯气,因此还原产物为1/2mol,氧化产物与还原产物的物质的量之比为5:1。
答案:5:1

 阅读快车系列答案
阅读快车系列答案【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
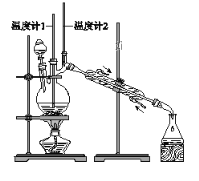
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物