题目内容
13.利用黄铜矿冶炼的主要原理为8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2,下列有关判断合理的是( )| A. | 避免污染,排放的尾气用98.3%的浓硫酸吸收 | |
| B. | CuFeS2中铁显+2价,该反应中只有Cu被还原 | |
| C. | 检验炉渣中含+2价铁的试剂是盐酸、KSCN溶液和氯水 | |
| D. | 冶炼铜的废料可以冶炼铁和制硫酸 |
分析 反应8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,Cu、O元素化合价降低,被还原,S元素化合价由-2价升高到+4价,被氧化,结合对应物质的性质解答该题.
解答 解:A.尾气中含有二氧化硫,不溶于浓硫酸,不能用浓硫酸吸收,故A错误;
B.反应中Cu、O元素化合价降低,被还原,故B错误;
C.炉渣中含有Fe2O3,加入盐酸、KSCN溶液和氯水不能鉴别+2价铁,可用稀硫酸溶解,然后用高锰酸钾检验,故C错误;
D.废料含有氧化铁、氧化亚铁,可冶炼铁,含有二氧化硫,可制硫酸,故D正确,
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与工业生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
6.下表为部分短周期元素的性质或原子结构:
(1)写出元素X的离子结构示意图: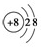 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.
(2)Y元素最高价氧化物对应水化物的化学式Al(OH)3,该物质与NaOH溶液反应的化学方程式为Al(OH)3+OH-═[Al(OH)4]-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由是只有Al具有金属性.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层电子数是K层电子数的3倍 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有5个电子 |
 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.(2)Y元素最高价氧化物对应水化物的化学式Al(OH)3,该物质与NaOH溶液反应的化学方程式为Al(OH)3+OH-═[Al(OH)4]-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由是只有Al具有金属性.
4.把a,b,c三块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;b、c相连时,c不易被腐蚀.则三种金属的活动性由强到弱的顺序为( )
| A. | a>b>c | B. | a>c>b | C. | c>b>a | D. | b>c>a |
1.下列说法正确的是( )
| A. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| B. | 桶烯(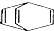 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 | |
| C. | 1.0mol的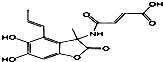 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol | |
| D. | 按系统命名法,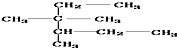 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 |
8.下列实验操作正确且能达到目的是( )
| A. | 将AlCl3溶液蒸发结晶提取无水AlCl3 | |
| B. | 用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 | |
| C. | 在温水瓶中加入Na2CO3溶液泡浸后加入盐酸除去内壁上CaSO4 | |
| D. | 将Cl2、HCl混合气体通过盛有NaHCO3饱和溶液的洗气瓶除去HCl |
18.根据某种共性,可将CO2、SO2归为一类氧化物.下列物质中,也属于同类氧化物的是( )
| A. | CaCO3 | B. | SO3 | C. | CuO | D. | KMnO4 |
2.为保证“西气东输”工程中送气和用气安全,可提前向部分路段输气管道通入1.1MPa某气体,你认为该气体可能是( )
| A. | 氮气 | B. | 氢气 | C. | 氧气 | D. | 氯气 |
3.下列物质中,既不能与盐酸反应,又不能烧碱溶液反应的是( )
| A. | 水玻璃 | B. | 二氧化硅 | C. | 一氧化碳 | D. | 氧化铝 |