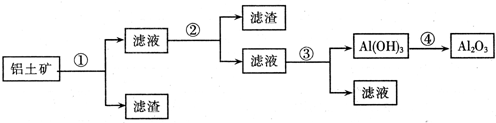
题目内容
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
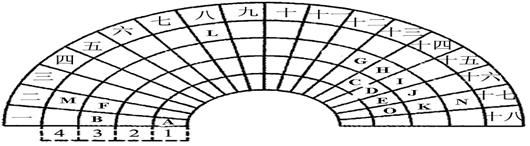
(1)D元素位于第 周期第 族。
(2)元素B、G、J、K、D的原子半径由大到小的顺序是 (用元素符号表示)。
(3)K、G两种元素的最高价氧化物对应的水化物能发生反应,请写出该反应的化学方程式: 。
(4)DA3、CE2、AK三种分子中,分子内所有原子都达到8电子稳定结构的分子为: (用化学式表示)。

(1)D元素位于第 周期第 族。
(2)元素B、G、J、K、D的原子半径由大到小的顺序是 (用元素符号表示)。
(3)K、G两种元素的最高价氧化物对应的水化物能发生反应,请写出该反应的化学方程式: 。
(4)DA3、CE2、AK三种分子中,分子内所有原子都达到8电子稳定结构的分子为: (用化学式表示)。
(1)二,ⅤA族;
(2)Na>Al >S>Cl >N;
(3)Al(OH)3 +3HClO4 ="=" Al(ClO4)3 + 3H2O;(4)CO2
(2)Na>Al >S>Cl >N;
(3)Al(OH)3 +3HClO4 ="=" Al(ClO4)3 + 3H2O;(4)CO2
试题分析:扇形元素周期表也是元素周期表中的种形式,结合常规的元素周期表,可以判断D元素位于第二周期第ⅤA族,A、B、C、D、E、F、G、H、J、K、M、N分别为H、Na、C、N、O、Mg、Al、Si、S、Cl、Ca、Br。元素B、G、J、K、D的原子半径由大到小的顺序是Na>Al >S>Cl >N;K、G两种元素的最高价氧化物对应的水化物是Al(OH)3 、HClO4,该反应的化学方程式:Al(OH)3 +3HClO4 ="=" Al(ClO4)3 + 3H2O
(4)DA3、CE2、AK三种分子为NH3、CO2、HCl,分子内所有原子都达到8电子稳定结构的分子为CO2。
点评:本题考查扇形元素周期表及元素的性质,具有一定的难度,考生要注意把常规的元素周期表知识进行迁移,准确判断。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目