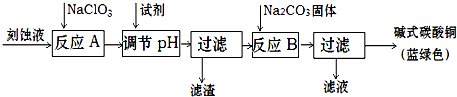
题目内容
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为( )


| A.5:4 | B.4:5 | C.3:5 | D.5:6 |
D







 溶液中还存在Fe3+,说明溶液中Cu2+没有反应,加入的铁全部反应,将粒子比例调整为:12:6:3和2:6:18,若溶液中由6molCu2+,就有10molFe3+发生反应,消耗5mol铁。
溶液中还存在Fe3+,说明溶液中Cu2+没有反应,加入的铁全部反应,将粒子比例调整为:12:6:3和2:6:18,若溶液中由6molCu2+,就有10molFe3+发生反应,消耗5mol铁。
练习册系列答案
相关题目
 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
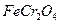 中Fe和
中Fe和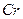 的氧化态都转化为+6氧化态,lmol
的氧化态都转化为+6氧化态,lmol 

 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;