题目内容
图中的图像是在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线。以下三个导电性实验,其中与A图变化趋势一致的是________,与B图变化趋势一致的是________,与C图变化趋势一致的是________。(1)Ba(OH )2溶液中滴入H2SO4溶液至过量
(2)醋酸溶液中滴入NH3×H2O至过量
(3)澄清石灰水中通入CO2至过量
(4)NH4Cl溶液中逐渐加入适量NaOH固体

解析:
| (1)随着H2SO4的加入,自由移动的离子渐少,I→O后I→大(H2SO4过量)。
(2)滴入NH3×H2O,但对溶液的导电能力影响很少。 (3)通入CO2后先生成CaCO3,CO2过量后又生成Ca(HCO3)2。 (4)尽管生成NH3×H2O,但对溶液的导电能力影响很小。
|

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案某实验小组对FeCl3的性质和用途展开了实验。
实验一:
实验步骤
①往锥形瓶中加入50 mL、3.0%的双氧水。
②分别往锥形瓶中加0.5 g不同的催化剂粉末,立即塞上橡皮塞。
③采集和记录数据。
④整理数据得出下表。
表:不同催化剂催化双氧水分解产生O2的压强对反应时间的斜率
| 催化剂 | 氯化铁 | 二氧化锰 | 猪肝 | 马铃薯 |
| 压强对时间的斜率 | 0.0605 | 3.8214 | 0.3981 | 0.0049 |
(1)该“实验一”的实验名称是 ;
(2)催化效果最好的催化剂是 ;
实验二:氯化铁催化分解双氧水的最佳条件
该实验小组的同学在进行实验二时,得到了如下的数据。
表:不同浓度的双氧水在不同用量的FeCl3?6H2O作用下完全反应所需时间
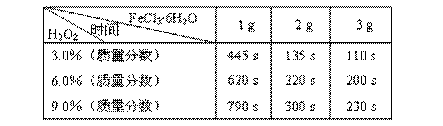
分析表中数据我们可以得出:
(3)如果从实验结果和节省药品的角度综合分析,当选用6.0%的双氧水时,加入______g FeCl3?6H2O能使实验效果最佳;
(4)进行该实验时,控制不变的因素有反应温度、 等;
(5)如图是2 gFeCl3?6H2O催化分解50 ml3.0%的双氧水时收集到的O2体积对反应时间示意图,请分别画出相同条件下1 g、3 g FeCl3?6H2O催化分解50 ml3.0%的双氧水时收集到的同温同压下O2体积对反应时间示意图,并作必要的标注;

讨论:有关FeCl3参加的可逆反应的两个问题:
(6)分别取若干毫升稀FeCl3溶液与稀KSCN
溶液混合,溶液呈血红色。限用FeCl3、KSCN、
KCl三种试剂,仪器不限,为证明FeCl3溶液与
KSCN溶液的反应是一个可逆反应,至少还要进行
次实验;
(7)一定浓度的FeCl3与KSCN两溶液反应达到平衡,在t1时刻加入一些FeCl3固体,反应重新达到平衡。若其反应过程可用如下的速率v―时间t图像表示。

请根据此图像和平衡移动规律求证新平衡下FeCl3的浓度比原平衡大
。