题目内容
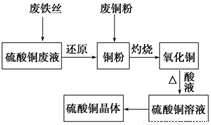
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体.生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有______________.
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物.原因是:
①灼烧不充分Cu未被完全氧化.
②CuO被还原.还原剂是________,该还原反应的化学方程式是________.
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2.通入O2的目的是(用化学反应方程式表示)________.
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是________.
答案:
解析:
解析:
(1)Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑(各2分,共6分)
(2)C或CO,(1分) 2CuO+C![]() 2Cu+CO2↑(2分)
2Cu+CO2↑(2分)
(3)2Cu+O2+2H2SO4![]() 2CuSO4+2H2O或2Cu+O2
2CuSO4+2H2O或2Cu+O2![]() 2CuO,CuO+H2SO4
2CuO,CuO+H2SO4![]() CuSO4+H2O(2分)
CuSO4+H2O(2分)
(4)生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2(2分)

练习册系列答案
相关题目