题目内容
已知氧化性KMnO4>HNO3,Bi位于周期表中第ⅤA族,+3价较稳定,KBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①滴加适量KBiO3溶液,溶液变为紫红色
②继续滴加适量H2O2,紫红色褪去,并有气泡产生
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色
④最后通入足量的SO2气体
请回答下列问题:
(1)KMnO4、KBiO3、H2O2的氧化性由强到弱的顺序是______________________________________。
(2)实验④中的现象为____________________________________________________________。
(3)实验③反应的离子方程式是____________________________________________________。
(提示:该反应须在酸性条件下进行)
(1)KBiO3>KMnO4>H2O2
(2)紫红色褪去,生成白色沉淀
(3)5PbO2+2Mn2++4H+ =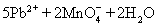
【解析】(1)由①中现象可知:KBiO3把Mn(NO3)2氧化生成KMnO4,则KBiO3的氧化性强于KMnO4的氧化性;由②中现象可知:KMnO4氧化H2O2产生O2,自身被还原为Mn2+,则KMnO4的氧化性强于H2O2的氧化性;综上所述:KMnO4、KBiO3、H2O2的氧化性由强到弱的顺序是:KBiO3>KMnO4>H2O2。
(2)④中KMnO4氧化SO2气体生成 ,自身又被还原为Mn2+,
,自身又被还原为Mn2+, 和③中生成的Pb2+反应生成白色沉淀。
和③中生成的Pb2+反应生成白色沉淀。
(3)由实验现象可知③中是PbO2氧化Mn2+生成KMnO4,自身被还原为Pb2+,根据电子守恒和电荷守恒即可配平写出方程式。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目




