题目内容
Fe(OH)2为白色絮状物,易被空气中O2氧化。在设计制取Fe(OH)2时,要注意防止它被氧化。请你根据所提供的实验用品,设计制取较纯净的Fe(OH)2的方法。实验用品除图4-26中所示外,还有玻璃棒、药匙、普通漏斗及滤纸、滴管、试管、酒精灯、石棉网(其他起支撑、固定作用的用品略)、小铁棒、石墨棒、久置绿矾、NaOH溶液、久置蒸馏水、苯、四氯化碳、无水乙醇等。方法一:隔绝空气的复分解反应法(完成填空)。
(1)将NaOH溶液煮沸并冷却后待用。
(2)配制纯FeSO4溶液的方法:__________________________________。
(3)制较纯的Fe(OH)2沉淀的方法:______________________________。
方法二:还原性气氛中复分解反应法。
如图4-26为Fe(OH)2制备实验的改进装置。请回答:
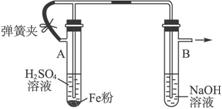
图4-26
(1)如何操作才能较长时间观察到白色絮状沉淀?
(2)为何能在较长时间内观察到Fe(OH)2白色沉淀?
方法三:隔绝空气电解法。
应用如图4-27所示的电解实验可制得白色纯净的Fe(OH)2沉淀。
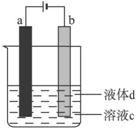
图4-27
(1)a电极材料为_______________,电极反应式为__________________。
(2)电解液c可以是________。
A.蒸馏水 B.NaOH溶液 C.无水乙醇 D.稀H2SO4溶液
(3)根据①与②写出电解的化学方程式_____________________________。
(4)液体d为_________,其作用为___________________________________________。
(5)当电解一段时间看到白色沉淀后,再反接电源,除了电极上看到气泡外,混合物中另一明显现象为__________________________。
方法一:(2)用药匙取适量绿矾于洁净的小烧杯中,然后加入适量煮沸过的蒸馏水和少量稀硫酸,同时加入适量铁粉,用玻璃棒充分搅拌、过滤后将滤液转移于细口试剂瓶备用
(3)取适量新配制的FeSO4溶液于试管中,然后加入1 mL苯,再将吸有NaOH溶液的滴管插于液面以下,逐渐加入NaOH溶液,在苯层下有白色的Fe(OH)2沉淀生成
方法二:(1)装入药品后,先打开弹簧夹,H2通过导管进入试管B把溶液中及溶液上方的空气都由试管B的支管排出,待反应较缓时,夹住弹簧夹,产生的H2的压强将含Fe2+的溶液由A压入B的NaOH溶液中,产生白色的Fe(OH)2沉淀。
(2)因为Fe(OH)2是在H2的还原性气氛中产生的。
方法三:(1)小铁棒 Fe-2e-====Fe2+ (2)B (3)Fe+2H2O![]() Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
(4)苯 隔绝空气,防止Fe(OH)2被氧化
(5)白色沉淀变为灰绿色,最终变成红褐色沉淀

 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案下列有关铁及其化合物的说法中正确的是
| A.Fe3O4是一种红棕色粉末,俗称铁红 |
| B.Fe(OH)2为白色固体,不溶于水,能在空气中稳定存在 |
| C.除去FeCl2中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤 |
| D.检验FeCl2溶液是否变质的方法是:加入KSCN溶液,观察是否有血红色沉淀产生 |