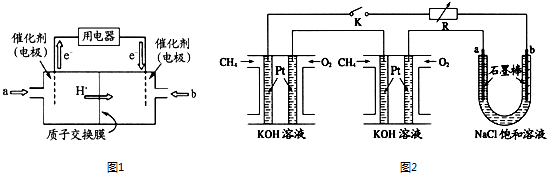
��Ŀ����
����Ŀ��д�����з�Ӧ���Ȼ�ѧ����ʽ
��1��N2��g����H2��g����Ӧ����1mol NH3��g�����ų�46.1KJ������
��2��0.5mol CH4��ȫȼ������CO2��g����H2O��l��ʱ���ų�445kJ��������
��3����ͼ��ʾ��NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ�� 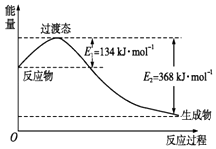
��4���Ͻ�������Ͼ�����������������ܣ�����Ͻ�ɴ���CO��H2�ϳ�CH4�ķ�Ӧ���¶�ΪTʱ���÷�Ӧ���Ȼ�ѧ����ʽΪ
��֪�¶�ΪTʱ��
CH4��g��+2H2O�TCO2��g��+4H2��g����H=+165KJmol
CO��g��+H2O��g���TCO2��g��+H2��g����H=��41KJmol��
���𰸡�
��1���⣺��ΪN2��g����H2��g����Ӧ����1mol NH3��g�����ų�46.1KJ��������1molN2��g����3molH2��g����Ӧ����2mol NH3��g�����ų�46.1��2KJ���������Է�Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��2NH3��g����H=��92.2kJmol��1���ʴ�Ϊ��N2��g��+3H2��g��2NH3��g����H=��92.2kJmol��1
��2���⣺��Ϊ0.5mol CH4��ȫȼ������CO2��g����H2O��l��ʱ���ų�445kJ����������1mol CH4��ȫȼ������CO2��g����H2O��l��ʱ���ų�890kJ�����������Է�Ӧ���Ȼ�ѧ����ʽΪ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����=��890kJmol��1���ʴ�Ϊ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����=��890kJmol��1
��3���⣺��ͼ��֪��1mol NO2��1mol CO��Ӧ����CO2��NO�ų�����Ϊ��368��134=234kJ��
��Ӧ�Ȼ�ѧ����ʽΪ��NO2��g��+CO��g��=NO��g��+CO2��g����H=��234 kJmol��1 ��
�ʴ�Ϊ��NO2��g��+CO��g��=NO��g��+CO2��g����H=��234 kJmol��1
��4��CO��g��+3H2��g��=CH4��g��+H2O��g����H=��206kJ?mol��1
���������⣺��4����֪����CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165kJmol��1
��CO��g��+H2O��g���TCO2��g��+H2��g����H=��41kJmol��1 ��
���ݸ�˹���ɣ��ک��ٿɵã�CO��g��+3H2��g��=CH4��g��+H2O��g����H=��206kJmol��1 ��
���Դ��ǣ�CO��g��+3H2��g��=CH4��g��+H2O��g����H=��206kJmol��1 ��

 �Ķ��쳵ϵ�д�
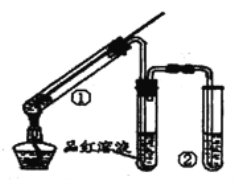
�Ķ��쳵ϵ�д�����Ŀ�������� 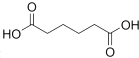 ��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£�
��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£� 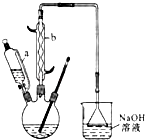
![]()
�����õ����й��������£�
���� | �ܶȣ�20�棩 | �۵� | �е� | �ܽ��� | ��Է������� |
������ | 0.962g/cm3 | 25.9�� | 160.8�� | 20��ʱˮ���ܽ��3.6g���ɻ������Ҵ����� | 100 |
�Ҷ��� | 1.36g/cm3 | 152�� | 337.5�� | ��ˮ�е��ܽ�ȣ�15��ʱ��1.44g��25��ʱ2.3g���������Ҵ��������ڱ� | 146 |
ʵ�鲽�����£�
I����������ƿ�м���16mL 50%�����ᣨ�ܶ�Ϊ1.31g/cm3�����ټ���1��2����ʯ����Һ©����ʢ����5.4mL��������
��ˮԡ����������ƿ��50�����ң���ȥˮԡ�������μ�5��6�λ�������ҡ��������ƿ���۲쵽�к���ɫ����ų�ʱ�������μ�ʣ�µĻ�������ά�ַ�Ӧ�¶���60�桫65��֮�䣮
��������ȫ��������������80�桫90��ˮԡ����Լ10min��ע������¶ȣ���ֱ������ɫ��������Ϊֹ��
IV�����Ƚ���ӦҺ�����ձ��У������ˮԡ����ȴ�������������ˡ�ϴ�ӵôֲ�Ʒ��V���ֲ�Ʒ���ᴿ�����Ϊ5.7g��
��ش��������⣺
��1������b������Ϊ ��
��2����������ƿ�еμӻ�����ʱ��Ҫ���ƺû������ĵ������ʣ���ֹ��Ӧ���ھ��ҵ����¶�Ѹ����������������ɽ����صĺ�������о�һ�����ܲ����ĺ���� ��
��3����֪��NaOH��Һ����β��ʱ��������ط�Ӧ����ʽΪ��2NO2+2NaOH�TNaNO2+NaNO3+H2O��NO+NO2+2NaOH�T2NaNO2+H2O��������ô�����Һ����β��ʱҲ�ܷ������Ʒ�Ӧ������ط�Ӧ����ʽΪ���� ��
��4��Ϊ�˳�ȥ���ܵ����ʺͼ��ٲ�Ʒ��ʧ���ɷֱ��ñ�ˮ��ϴ�Ӿ��壮
��5���ֲ�Ʒ�������ᴿ����ʵ��������ƣ�����ʵ�����õ��ļ��������Ϊ ��