题目内容
【题目】有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③.甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量.
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为g.
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊.再将反应后的固体与足量的稀硝酸微热,充分反应后,有bg固体剩余,该剩余固体的化学式为 . 样品②中氧化铜质量为g (以含a、b的代数式表示).
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为 .
【答案】
(1)6.0
(2)C;![]()
(3)![]() mol≤n(CuO)≤
mol≤n(CuO)≤ ![]() mol
mol
【解析】解:(1)Cu和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的气体是NO,n(NO)= ![]() =0.05mol,根据转移电子相等得n(Cu)=
=0.05mol,根据转移电子相等得n(Cu)= ![]() =0.075mol,根据Cu原子守恒得n(CuO)=n(Cu)=0.075mol,m(CuO)=0.075mol×80g/mol=6.0g,所以答案是:6.0;(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊,说明生成的气体是CO而不是CO2 , 则C过量、CuO不足量,Cu和稀硝酸反应、C和稀硝酸不反应,所以bg固体是C,参加反应的CuO和C的质量=(a﹣b)g,二者反应方程式为CuO+C
=0.075mol,根据Cu原子守恒得n(CuO)=n(Cu)=0.075mol,m(CuO)=0.075mol×80g/mol=6.0g,所以答案是:6.0;(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊,说明生成的气体是CO而不是CO2 , 则C过量、CuO不足量,Cu和稀硝酸反应、C和稀硝酸不反应,所以bg固体是C,参加反应的CuO和C的质量=(a﹣b)g,二者反应方程式为CuO+C ![]() Cu+CO↑, 设CuO的质量为x,
Cu+CO↑, 设CuO的质量为x,
CuO+C | (CuO+C) |
80 | 92 |
x | (a﹣b)g |
80:92=x:(a﹣b)g
x= ![]() =
= ![]() ,
,
所以答案是:C; ![]() ;(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,减少的质量为O、C的质量,生成的气体可能是CO或CO2 ,
;(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,减少的质量为O、C的质量,生成的气体可能是CO或CO2 ,
CuO+C ![]() Cu+CO↑
Cu+CO↑
2CuO+C ![]() 2Cu+CO2↑,
2Cu+CO2↑,
假设生成的气体是CO,根据方程式得n(CuO)=n(CO)= ![]() =
= ![]() mol,
mol,
假设生成的气体是CO2 , 根据方程式得n(CuO)=2n(CO2)=2× ![]() =
= ![]() mol,
mol,
实际上生成的气体介于二者之间,所以 ![]() mol≤n(CuO)≤
mol≤n(CuO)≤ ![]() mol,
mol,
所以答案是: ![]() mol≤n(CuO)≤
mol≤n(CuO)≤ ![]() mol.
mol.

 名师指导期末冲刺卷系列答案
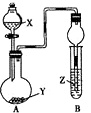
名师指导期末冲刺卷系列答案【题目】利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象不正确的是( )
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
A.A
B.B
C.C
D.D