题目内容
在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )。
A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8x-2y) kJ·mol-1
【答案】
C
【解析】

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
(2011·威海毕业考试)在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol/L,c(H2O2)=0.400 mol/L时的反应速率为( )
|
实验编号 |
1 |
2 |
3 |
4 |
5 |
|
c(HI)/(mol·L-1) |
0.100 |
0.200 |
0.300 |
0.100 |
0.100 |
|
c(H2O2)/(mol·L-1) |
0.100 |
0.100 |
0.100 |
0.200 |
0.300 |
|
v/(mol·L-1·s-1) |
0.00760 |
0.0153 |
0.0227 |
0.0151 |
0.0228 |
A.0.0380 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1

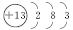
 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。