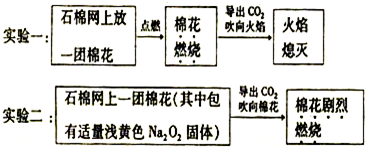
题目内容
某种常见金属的部分性质如下:银白色固体,硬度较小,密度为2.70g/cm3,熔点为660.4℃,导电性、导热性、延展性良好。
(1)试推断该金属可能的一种用途______。
(2))请提出你想探究的有关该金属化学性质的两个问题:①______;②______。
(3)请设计实验方案对你所提出的两个问题进行探究(简述步骤、现象及结论):
①__________________________;②__________________________。
(1)试推断该金属可能的一种用途______。
(2))请提出你想探究的有关该金属化学性质的两个问题:①______;②______。
(3)请设计实验方案对你所提出的两个问题进行探究(简述步骤、现象及结论):
①__________________________;②__________________________。
(1)做导线。(2)①该金属能否与稀盐酸反应②该金属能否与硫酸铜溶液反应。(3)①取少量该金属于试管中,滴入2~3 mL稀盐酸,若有气泡产生,则该金属能与稀盐酸反应。②取少量该金属于试管中,滴入2~3 mL硫酸铜溶液,若该金属表面有红色固体出现,则该金属能与硫酸铜溶液反应。
此题内涵丰富,思维量大,它不仅要求学生对金属的化学性质熟悉,对实验过程中操作、反应条件、现象、实验的可行性和安全性相关知识有深刻的理解,而且“问题与假设、探究程序、探究结论”均具有开放性,故此题答案具有不确定性和开放性,尤其第(3)小题突出考查学生的研究性学习能力,鼓励学生大胆假设,敢于探究,结合化学事实进行推理,既考查了学生对化学知识的掌握情况,又关注了学生对有关学科问题的理解和认识的过程,同时考查了科学探究的主要步骤和方法。这类试题有利于引导学生将学习的重点从过分强调知识的传承和积累向知识的探究过程转化,从被动接受知识向主动获得知识转化,有利于考查“过程与方法”,从而培养学生的科学探索精神、实事求是的科学态度和创新意识。

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
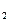 )进行如下实验探究。
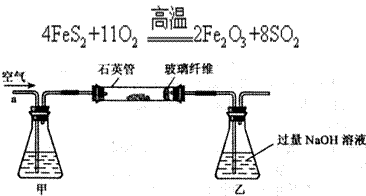
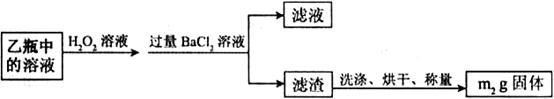
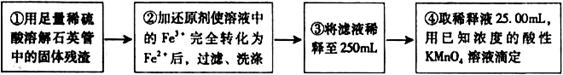
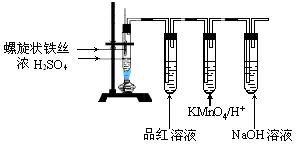
)进行如下实验探究。 g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为: