��Ŀ����
����Ŀ����֪��3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO�� + 4H2O
��1����˫�ŷ������ת�� 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO�� + 4H2O��________________��
��2���˷�Ӧ�л�ԭ���������������ʵ���֮��Ϊ��___________�����ɱ�״̬��2.24 L ����ʱת�Ƶ���_________________����
��3��������ͭƬ�м���һ����ϡ���ᣬ��ʼһ��ʱ��ð�����ݵ����ʺ�������������ˣ�ԭ����__________________________________________��
��4���ڹ���ͭƬ�м���һ����ϡ���ᣬ��Ӧ�������ټ���һЩϡ���ᣬ����NO����ð������д���������Ӧ�����ӷ���ʽ��______________________________________��
��5����֪һ������������ϡ���ᷴӦ����1 mol Fe��NO3)3 �� 3 mol Fe��NO3)2 ��������NO����______mol��
���𰸡�  3:2 0.3NA �˷�Ӧ�����¶����������ʼӿ� 3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NO�� + 4H2O 3
3:2 0.3NA �˷�Ӧ�����¶����������ʼӿ� 3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NO�� + 4H2O 3
��������(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO�� + 4H2O��Ӧ��Cu���ϼ���0�����ߵ�+2�ۣ�N��+5�۽��͵�+2�ۣ�ת�Ƶ�����3��2=6����˫���ŷ���ʾ���ӵ�ת�ƣ�����ʽΪ��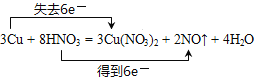 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2)��Ӧ��Cu���ϼ���0�����ߵ�+2�ۣ�CuΪ��ԭ����N��+5�۽��͵�+2�ۣ�����Ϊ������������������ֻ��2�ݣ���˻�ԭ���������������ʵ���֮��Ϊ3:2����״̬��2.24 L ��������ʵ���Ϊ0.1mol������(1)��֪��ת�Ƶ���0.3NA�����ʴ�Ϊ��3:2��0.3NA��
(3)ͭ��ϡ����ķ�Ӧ�Ƿ��ȷ�Ӧ�����ŷ�Ӧ�Ľ��У���Һ���¶������ߣ���Ӧ�����ӿ죬�ʴ�Ϊ���˷�Ӧ�����¶����������ʼӿ죻
(4)ͭ��ϡ���ᷴӦ����������ͭ������Һ���ټ���һЩϡ���ᣬ��Һ�����γ������ᣬ������ͭ��Ӧ���������NO����ð������Ӧ�����ӷ���ʽΪ3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NO�� + 4H2O���ʴ�Ϊ��3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NO�� + 4H2O��
(5)һ������������ϡ���ᷴӦ����1 mol Fe(NO3)3 �� 3 mol Fe(NO3)2 ��ת�Ƶĵ���Ϊ1mol��3+3mol��2=9mol��������ɵ�NO�����ʵ���=![]() =3mol���ʴ�Ϊ��3��
=3mol���ʴ�Ϊ��3��
