题目内容
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是
| A.Na+、Mg2+、Cl-、ClO - | B.NH3·H2O、SO32-、K+、Na+ |
| C.Fe2+、Na+、K+、NO3- | D.K+、Ca2+、Br-、Cl- |
D
解析试题分析:A、ClO -具有氧化性,可与SO2发生氧化还原反应;B、NH3·H2O具有碱性,可与酸性氧化物SO2反应;C、通入SO2后溶液显酸性,NO3-在酸性条件下可氧化Fe2+;D、可大量共存。
考点:考查离子共存问题。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
下列反应的离子方程式正确的是
| A.在硫化钠溶液中加入足量稀硝酸: S2-+ 2H+ = H2S↑ |
| B.往氯化铁溶液中通入硫化氢气体: 2Fe3++ S2-= 2Fe2++ S↓ |
| C.用惰性电极电解饱和食盐水:2Cl-+2H2O通电2OH-+ H2↑ + Cl2↑ |
D.乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH CH3COO-+NH4++2Ag↓+3NH3+H2O CH3COO-+NH4++2Ag↓+3NH3+H2O |
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g。
下列说法中正确的是
| A.该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.澄清透明的溶液中:H+、Fe2+、SO42-、NO3- |
| B.使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- |
| C.0.1 mol·L-1的BaCl2溶液中:K+、Na+、OH-、NO3ˉ |
| D.由水电离出的c(H+)=10-12 mol·L-1的溶液中:Mg2+、K+、Br-、HCO3- |
能正确表示下列反应的离子方程式的是
| A.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
B.NaHCO3溶液水解:HCO3-+H2O H3O+ +CO32- H3O+ +CO32- |
| C.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑ |
| D.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O |
下列实验所对应的离子方程式正确的是( )
| A.向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3- |
| B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+ |
| C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O |
| D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-=Fe4[Fe(CN)6]2↓ |
已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g 水;
② 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的 ,
, ;
;
草酸( )的
)的 ,
,
③相同条件下电离出S2-的能力:FeS>H2S>CuS,以下离子方程式错误的是( )
| A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
B. |
C. |
D.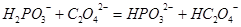 |
下列各组离子可能大量共存的是
| A.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH、S2-、Br- |
| B.遇pH试纸变红色的溶液:Fe2+、S2O、SO42-、Na+ |
| C.水电离出的c(H+) ?c(OH-) =10-28的溶液:Na+、S2-、NO3-、SO32- |
| D.能使KSCN显红色的溶液:Na+、NH4+、AlO、CO |