题目内容
(10分)将足量铁投入到200mLH2SO4与CuSO4的混合溶液中,充分反应后产生H21.12L(STP下),铁块质量减轻1.2g,求原溶液中c(H2SO4)及c(CuSO4)(假设反应前后溶液体积不变)。
0.25mol/L 1.0mol/L
考查物质的量的有关计算。主要是依据几个关系式即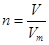 、
、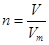 、n=m/M、c=n/V等。
、n=m/M、c=n/V等。
氢气在标准状况下的体积是1.12L
所以依据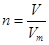 可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol
可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol
根据氢原子守恒可知
原硫酸的物质的量是0.05mol
因此根据c=n/V可知
硫酸的物质的量浓度是0.05mol÷0.2L=0.25mol/L
铁和硫酸铜反应的方程式是
Fe + CuSO4=FeSO4+Cu
1mol 1mol 1mol
X x x
置换出氢气消耗的铁是0.05mol
所以有(x+0.05mol)×56g/mol-64xg/mol=1.2g
解得x=0.2mol
所以硫酸铜的浓度是0.2mol÷0.2L=1.0mol/L
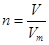 、
、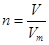 、n=m/M、c=n/V等。
、n=m/M、c=n/V等。氢气在标准状况下的体积是1.12L
所以依据
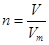 可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol
可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol根据氢原子守恒可知
原硫酸的物质的量是0.05mol
因此根据c=n/V可知
硫酸的物质的量浓度是0.05mol÷0.2L=0.25mol/L
铁和硫酸铜反应的方程式是
Fe + CuSO4=FeSO4+Cu
1mol 1mol 1mol
X x x
置换出氢气消耗的铁是0.05mol
所以有(x+0.05mol)×56g/mol-64xg/mol=1.2g
解得x=0.2mol
所以硫酸铜的浓度是0.2mol÷0.2L=1.0mol/L

练习册系列答案
相关题目
 mol
mol mol
mol mol
mol mol
mol