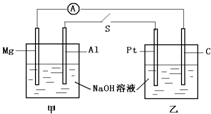
题目内容
根据如图,下列判断中不正确的是( )

| A.通入O2的电极的电极反应式为:O2+2H2O+4e-=4OH- |
| B.反应一段时间后,甲池中溶液的pH降低 |
| C.乙池中电极B上发生还原反应 |
| D.当乙池中的某一电极质量增加10.80g时,理论上甲池中消耗的气体至少为840mL(标准状况下) |

A.通入氧气的一极为原电池的正极,发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,故A正确;
B.甲池的总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O,消耗KOH,溶液pH减小,故B正确;
C.B连接原电池的正极,为电解池的阳极,发生氧化反应,故C错误;
D.当乙池中的某一电极质量增加 10.80g时,应为Ag的质量,为0.1mol,转移电子0.1mol,和甲池中电子转移量相等,应消耗
×0.1mol甲烷和
×0.1mol氧气,则总体积为0.1mol×(
+
)×22.4L/mol=0.84L=840mL,故D正确.
故选C.
B.甲池的总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O,消耗KOH,溶液pH减小,故B正确;
C.B连接原电池的正极,为电解池的阳极,发生氧化反应,故C错误;
D.当乙池中的某一电极质量增加 10.80g时,应为Ag的质量,为0.1mol,转移电子0.1mol,和甲池中电子转移量相等,应消耗
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 4 |
故选C.

练习册系列答案
相关题目