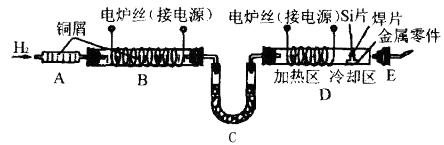
��Ŀ����
����Ŀ������100ml 0.5molL��1Na2CO3��Һ����Na+Ũ��Ϊ0.20molL��1����Һ�����в�����ȷ���ǣ� ��
A.����Na2CO3 ��Һת����250ml����ƿ�У�������ˮϡ�����̶��ߣ�ҡ��
B.����Na2CO3 ��Һת����250ml�ձ��У�����Ͳ��ȡ150ml����ˮ���룬����
C.����Na2CO3 ��Һת����250ml�ձ��У�����Ͳ��ȡ400ml����ˮ���룬����
D.����Na2CO3 ��Һת����500ml����ƿ�У�������ˮϡ�����̶��ߣ�ҡ��
���𰸡�D
�������� �⣺A������ƿ������Ϊϡ����������һ�ֶ�����������A����
B������ϡ��ǰ�������ӵ����ʵ������ֲ��䣬������Ҫ��Һ�����Ϊ�� ![]() mL=500mL������Һ������Ӧ������ƿ�н��У��������ձ��У���B����
mL=500mL������Һ������Ӧ������ƿ�н��У��������ձ��У���B����
C������һ�����һ��Ũ�ȵ���ҺҪʹ������ƿ�����ݣ��������ձ��н��У���100mL��̼������Һ����400mLˮ֮��������Һ�������һ����500mL����C����
D������ϡ��ǰ�������ӵ����ʵ������ֲ��䣬������Ҫ��Һ�����Ϊ�� ![]() mL=500mL��Ҫʹ��500mL������ƿ����D��ȷ��
mL=500mL��Ҫʹ��500mL������ƿ����D��ȷ��
��ѡD��
�����㾫����������Ĺؼ������������ʵ���Ũ�ȵĸ�������֪ʶ�������Ե�λ�������������B�����ʵ�������ʾ��Һ��ɵ�����������������B�����ʵ���Ũ�ȣ�����CB=nB(mol)��V(L) ��nB������B�����ʵ�����V����Һ���������λ��mol��L��1��

 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ��±����������ֶ����ڵ�ԭ�Ӱ뾶����Ҫ���ϼۣ���֪���ԭ�Ӱ뾶Ϊ0.089nm����
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +2 | +3 | +6����2 | ��1 | ��2 |
��1����Ԫ�ش��ű�����������ڱ��ж�Ӧλ�ã�����Ϊ���ڱ���һ���֣��� 
��2��BԪ�ش���Ԫ�����ڱ��������壻
��3����Ԫ�����ڱ����ķֽ紦�������ҵ��ư뵼����ϵ�Ԫ�أ�
��4����������Ԫ�ص�����������Ӧˮ������������ǿ�������ѧʽ����
��5��C��E�γɵĻ�����M����ʹ���Ը��������Һ��ɫ��������M���ԣ�
��6��д��D��ǿ����Һ��Ӧ�����ӷ���ʽ ��