题目内容
【题目】常温下,下图表示向10mLpH=3的A溶液中加水稀释到V1mL溶液pH的变化。下列说法中正确的是

A. 若V1=100,则稀释前A的浓度一定是0.001mol/L
B. a点水的电离程度一定小于b点
C. 若A为NH4Cl和HCl的混合溶液,则V1一定大于100
D. 若A为NH4Cl和NH3·H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
【答案】C
【解析】A.10mLpH=3的A溶液中加水稀释到V1mL溶液,pH=4,若V1=100,则是稀释10倍溶液pH增大一个单位,证明是强酸,但可以是一元酸也可以是二元酸,所以原酸溶液浓度不一定为0.001mol/L,故A错误;B.向10mLpH=3的A溶液可能是酸溶液,也可能是水解的盐溶液,若为酸溶液a点水的电离程度一定小于b点,若为水解的盐溶液加入水稀释促进水解正向进行,水的电离程度减小,a点水的电离程度大于b点,故B错误;C.若A为NH4Cl和HCl的混合溶液,溶液中铵根离子水解溶液显酸性,加水稀释促进水解平衡正向进行,加水稀释到100mL,不考虑水解平衡移动,溶液pH变化为4,单铵根离子水解,溶液PH小于4,所以V1一定大于100,故C正确; D.若A为NH4Cl和NH3H2O的混合溶液,溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),溶液显酸性,则(H+)>c(OH-),c(NH4+)<c(Cl-),故D错误;故选C。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
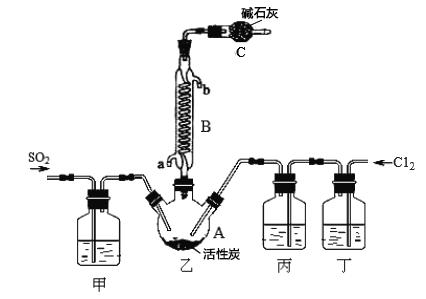
(1)从下表中选择相应的装置完成填空:
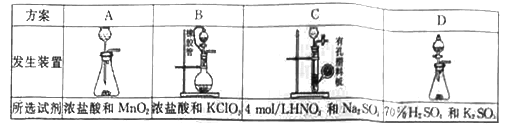
①制备SO2选________(填字母)。
②写出用所选装置制取Cl2的离子方程式_________________。
(2)合成SO2C12的装置图中仪器B的名称为_________________;丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)为提高本实验中的产率,在实验操作中还需要注意的事项有(只答—条即可)__________。
(6)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
