题目内容
【题目】现有A、B、C、D、E、F、G七种物质或粒子,其中A、B、C、D、G都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,连线不一定表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B、G的为原子晶体,A晶体硬度最大.工业上利用单质A的同素异形体与B物质发生置换反应来制取单质G的粗产品,G单质常用于制备太阳能电池.C、D、E、F均含有10个电子,且D是阳离子,D与F的组成元素相同.C、E、F为分子晶体,E常温下呈液态溶剂. 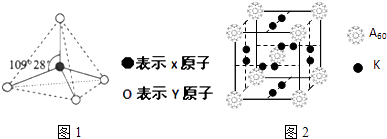
(1)与A同主族的第四周期元素基态原子的价电子排布图为 .
(2)D的中心原子M的杂化类型为 .
(3)科学家把A60和钾(K)掺杂在一起制造出了一种化合物,其晶胞如图2所示,该物质在低温时是一种超导体.其化学式为 .
(4)继A60后,科学家又合成了G60、M60 , A、G、M原子电负性由大到小的顺序是(用元素符号表示).G60分子中每个G原子只跟相邻的3个G原子形成共价键,且每个G原子最外层都满足8电子稳定结构,则1mol G60分子中π键的数目为 .
(5)已知某红紫色配合物的组成为CoCl3(F)5H2O(配位数为6).加足量AgNO3于该配合物溶液中,有AgCl沉淀生成,但加热至沸腾又有AgCl沉淀生成,且其质量为第一次AgCl沉淀量的二分之一.则该配合物的化学式为
【答案】
(1)![]()
(2)sp3杂化
(3)K3C60
(4)N>C>Si;1.806×1025
(5)[CoCl(NH3)5]Cl2?H2O
【解析】解:A、B、C、D、E、F、G七种物质或粒子,其中A、B、C、D、G都具有正四面体结构或结构单元,C、D、E、F均含有10个电子,且D是阳离子,故D为NH4+ , D与F的组成元素相同,故F为NH3 , E构成的物质常温下呈液态,故E为H2O,C、E、F为分子晶体,故C为CH4;A、B、G为原子晶体,A晶体硬度最大,则A为金刚石,工业上利用单质A的同素异形体与B物质发生置换反应来制取单质G的粗产品,G单质常用于制备太阳能电池,则B为二氧化硅,G为Si.
(1.)与A同主族的第四周期元素为Ge,价电子排布式为4s24p2 , 基态原子的价电子排布图为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)D为NH4+ , 中心原子M为N原子,N原子价层电子对数为4,采取sp3杂化,所以答案是:sp3杂化;
(3.)晶胞中C60分子数目为8× ![]() +1=2,K原子数目为2×6×
+1=2,K原子数目为2×6× ![]() =6,故化学式为:K3C60 , 所以答案是:K3C60;
=6,故化学式为:K3C60 , 所以答案是:K3C60;
(4.)同一周期从左到右,电负性逐渐增大,同一主族从上到下,电负性逐渐减小,因此原子电负性由大到小的顺序是:N>C>Si,
每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30,则1mol G60分子中π键的数目为 1.806×1025 , 所以答案是:N>C>Si;1.806×1025;
(5.)CoCl3(NH3)5H2O水溶液加AgNO3于该化合物溶液中,有AgCl沉淀生成,说明外界离子有Cl﹣ , 加热至沸腾有AgCl沉淀生成,说明配体中含有Cl﹣ , 且其质量为第一次沉淀量的二分之一,说明外界离子有Cl﹣与配体Cl﹣之比为2:1,该配离子化学式可能为[CoCl(NH3)5]Cl2H2O,所以答案是:[CoCl(NH3)5]Cl2H2O.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案【题目】A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
B | B原子得到一个电子后3p轨道全充满 |
C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
E | E的单质是日常生活中用量最大的金属材料 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素第一电离能的大小I1(B)I1(Y).(填“>”或“=”或“<”)
(2)E元素原子的核外电子排布式为 .
(3)B元素最高价含氧酸一定比D元素最高价含氧酸的酸性(填“强”或“弱”).
(4)C单质分子中σ键和π键的个数比为 , C的氢化物在同族元素的氢化物中沸点出现反常,其原因是 .
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: . 写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式: .