题目内容
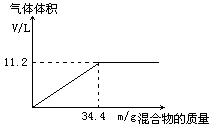
【题目】在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物的质量和产生气体的体积(标准状况)关系。
(1)试计算NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
【答案】解:(1)5mol/L (3分) (2)15.68 L(3分) (3)16.8L(3分)
【解析】考查化学计算的过量与不足问题
(1)由图像可知,随着混合物的质量的增加,所得到的氨气的最大体积为11.2L
由反应NH4++OH-![]() NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
34.4g混合物中所含NH4+的量为0.5mol,设NH4NO3、(NH4)2SO4的物质的量分别为x、y
80x+132y=34.4 x+2y=0.5
解得x=0.1mol y=0.2mol,即两者的物质的量比为1:2
(2)140mlNaOH提供的OH-的物质的量为0.7mol
固体混合物的质量为51.6g,可计算出NH4NO3、(NH4)2SO4的物质的量分别为0.15mol、0.3mol,提供NH4+的量为0.75mol
由反应NH4++OH-![]() NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
(3)180mlNaOH提供的OH-的物质的量为0.9mol,与固体相比NH4+的量不足,所生成氨气为0.75mol,标准状况下体积为22.4×0.75=16.8L

 黄冈冠军课课练系列答案
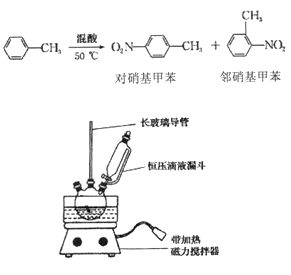
黄冈冠军课课练系列答案【题目】实验室制备一硝基甲笨(主要含邻硝基甲苯和对硝基甲苯)的反应原理、实验装
密度/(g·cm-3) | 沸点/℃ | 式量 | 溶解性 | |
甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
实验步骤:
① 配制混酸,组装如图反应装置。取100 mL 烧杯,用10 mL 浓硫酸与30 mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15 mL 甲苯(折合质量13.0g)加入三颈烧瓶中。
② 向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀。
③ 在50一60℃ 下发生反应,直至反应结束。
④ 除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
请回答下列问题:
(l)配制40mL 混酸的操作是________________
(2)装置中还缺少__________(填仪器名称)。如果温度超过60℃,将会有____(填物质名称)生成。
(3)分离粗产品和水的操作方法是__________
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是_______
(5)为了得到更纯净的硝基苯,还须先向液体中加入_______除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是________。