题目内容
( 10分)水中Ca2+、Mg2+能形成“水垢”使水质变得不适于家庭和工业使用,回答下列问题:
(1)石灰-苏打法被用来大规模软化生活用水,写出配平的离子反应方程式。
(2)另一种软化硬水的方法是离子交换法, 交换过程是在装有离子交换树脂的交换柱或交换床中完成的。
A. 用方程式表示离子交换过程
B. 如何对树脂进行再生?
C. 离子交换水可作为饮用水吗?为什么?
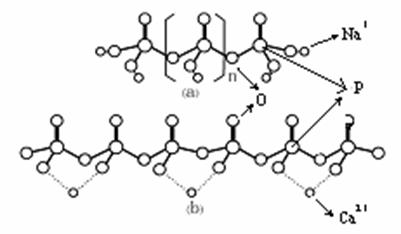
(3)工业上常用格氏盐(某种磷酸盐)作为锅炉用水的软化剂,为什么?画出格氏盐的结构示意图以及格氏盐与钙离子结合后形成化合物的结构示意图。
(1) Ca2+(aq) + CO32-(aq) ![]() CaCO3(s) (1分)
CaCO3(s) (1分)
Mg2+(aq) + 2 OH-(aq) ![]() Mg(OH)2 (s) (1分)
Mg(OH)2 (s) (1分)
(2)A. 2 Na(R-COO)(s) + Ca2+(aq) ![]() Ca(R-COO)2(s) + 2 Na+(aq) (1分)
Ca(R-COO)2(s) + 2 Na+(aq) (1分)
B. 再生处理使用浓度较高的NaCl水溶液按逆反应方向进行置换。 (1分,如果没写“高浓度”扣0.5分)
C. 离子交换法软化硬水虽然解决了Ca2+、Mg2+等离子带来的问题, 但却不是理想的饮用水。 (1分)
由于水中Na+离子浓度升高, 因而特别不适于患高血压病的人群饮用。(1分)
(3)格氏盐能同Ca2+、Mg2+等离子配位生成可溶性配合物,(1分)阻止水垢形成机理是晶体表面被吸附的多阴离子遮盖,使晶体生长变得缓慢,晶体严重变形,而难以聚结成为水垢,因此它可作为锅炉用水的软化剂。(1分)
结构示意图:(各1分)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(10分) 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况。以下情况相同。)


(1)生成沉淀的质量刚好最大时,反应的方程式为: __________________
(2)原混合物中Ca(OH)2的质量为 _________ g。
(3)沉淀恰好溶解时,消耗CO2的体积为 __________ mL
(4)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式。
| V的取值范围 | m=f(V) |
| | |
| | |
| | |




(10分)下列各组物质的分离或提纯,应选用下述方法的哪一种?(用编号填空)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 |
① 除去Ca(OH)2溶液中悬浮的CaCO3 ;
② 从碘水中提取碘 ;
③ 用自来水制取蒸馏水 ;
④ 除去碳酸钠固体中少量的碳酸氢钠固体 ;
⑤ 分离植物油和水 ;
( 10分)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、蒸发结晶 F、加热分解 |
(2)从碘水中提取碘 ;
(3)用自来水制取蒸馏水 ;
(4)分离植物油和水 ;
(5)除去 KCl 中少量 KClO3 。