题目内容
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.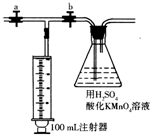
测定原理:KMnO4 (H+)溶液为强氧化剂,可氧化甲醛和草酸.
有关离子方程式为:4MnO4-+5HCHO+12H+→4Mn2++5CO2↑+11H2O;2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;测定装置:部分装置如右图所示(a、b为止水夹).
测定步骤:
①收集待检新装修的房屋居室空气5L.
②准确量取5.00mL 1.00×10-3mol/L的高锰酸钾溶液于250mL锥形瓶中,滴入3滴6mol/L
的H2SO4溶液,加水45mL稀释,备用.
③将1.00×10-3mol/L的草酸标准溶液置于酸式滴定管中备用.
④打开a,关闭b,用注射器抽取100mL新装修的房屋的室内空气.关闭a,打开b,缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应.再如此重复4次.
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积.
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00mL).3次实验所消耗草酸溶液的体积平均值为12.38mL.回答以下问题:
(1)使用______量取5.00mL高锰酸钾溶液.
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低?______.
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点.______.
(4)计算该居室内空气中甲醛的浓度______mg/m3,该居室的甲醛______(填“是”或“否”)超标.
解:(1)由于高锰酸钾溶液具有强氧化性,不能使用碱式滴定管,应该选用酸式滴定管盛装,
故答案为:酸式滴定管;
(2)如果注射器压送气体速度过快,空气中的甲醛没有完全被高锰酸钾溶液吸收,导致测定结果偏低,
故答案为:甲醛来不及被吸收,影响测定结果;使结果偏低;
(3)高锰酸钾溶液是紫红色的溶液,所以不需要添加指示剂;反应结束时,溶液的紫红色会褪去,所以滴定终点判断方法为:最后一滴草酸标准溶液滴下,溶液紫红色褪去且半分钟内不恢复,即为滴定终点,
故答案为:不需要;以高锰酸钾为指示剂,最后一滴草酸标准溶液滴下,溶液紫红色褪去且半分钟内不恢复,即为滴定终点;
(4)5.00mL 1.00×10-3mol/L的高锰酸钾溶液中含有的高锰酸钾的物质的量为:0.005L×1.00×10-3mol/L=5×10-6mol,
高锰酸钾消耗的草酸物质的量为:1.00×10-3mol/L×0.01238L=1.238×10-5mol,根据反应2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O,
草酸消耗的高锰酸钾的物质的量为: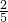 ×1.238×10-5mol=4.952×10-6mol,
×1.238×10-5mol=4.952×10-6mol,
甲醛中的高锰酸钾的物质的量为:5×10-6mol-4.952×10-6mol=4.8×10-8mol,根据反应4MnO4-+5HCHO+12H+→4Mn2++5CO2↑+11H2O,
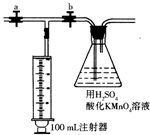
500mL空气中含有的甲醛物质的量为: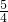 ×4.8×10-8mol=6×10-8mol,
×4.8×10-8mol=6×10-8mol,
1m3空气中含有的甲醛物质的量为:6×10-8mol× =1.2×10-4mol,甲醛的质量为:1.2×10-4mol×30g/mol=3.6mg<0.08mg,所以该空气合格,
=1.2×10-4mol,甲醛的质量为:1.2×10-4mol×30g/mol=3.6mg<0.08mg,所以该空气合格,
故答案为:3.6;是.
分析:(1)高锰酸钾溶液具有强氧化性,能够氧化橡胶管;
(2)注射器压送气体速度过快,空气中甲醛没有完全被吸收;
(3)由于高锰酸钾溶液是紫红色溶液,不需要使用其他指示剂;当反应完毕,溶液中高锰酸钾溶液的紫红色会消失;
(4)先计算出总的高锰酸钾的物质的量,然后利用滴定数据计算出草酸消耗的高锰酸钾的物质的量,再计算出甲醛消耗高锰酸钾的物质的量,最后计算出1m3空气中含有的甲醛的质量,根据居室中甲醛含量标准,判断出空气质量情况.
点评:本题考查了空气中甲醛含量测定,根据反应的化学方程式,计算室内空气中甲醛含量,并与标准进行对照,判断室内甲醛是否超过标准,本题难度中等.
故答案为:酸式滴定管;
(2)如果注射器压送气体速度过快,空气中的甲醛没有完全被高锰酸钾溶液吸收,导致测定结果偏低,
故答案为:甲醛来不及被吸收,影响测定结果;使结果偏低;
(3)高锰酸钾溶液是紫红色的溶液,所以不需要添加指示剂;反应结束时,溶液的紫红色会褪去,所以滴定终点判断方法为:最后一滴草酸标准溶液滴下,溶液紫红色褪去且半分钟内不恢复,即为滴定终点,
故答案为:不需要;以高锰酸钾为指示剂,最后一滴草酸标准溶液滴下,溶液紫红色褪去且半分钟内不恢复,即为滴定终点;
(4)5.00mL 1.00×10-3mol/L的高锰酸钾溶液中含有的高锰酸钾的物质的量为:0.005L×1.00×10-3mol/L=5×10-6mol,
高锰酸钾消耗的草酸物质的量为:1.00×10-3mol/L×0.01238L=1.238×10-5mol,根据反应2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O,
草酸消耗的高锰酸钾的物质的量为:
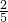 ×1.238×10-5mol=4.952×10-6mol,
×1.238×10-5mol=4.952×10-6mol,甲醛中的高锰酸钾的物质的量为:5×10-6mol-4.952×10-6mol=4.8×10-8mol,根据反应4MnO4-+5HCHO+12H+→4Mn2++5CO2↑+11H2O,
500mL空气中含有的甲醛物质的量为:
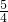 ×4.8×10-8mol=6×10-8mol,
×4.8×10-8mol=6×10-8mol,1m3空气中含有的甲醛物质的量为:6×10-8mol×
 =1.2×10-4mol,甲醛的质量为:1.2×10-4mol×30g/mol=3.6mg<0.08mg,所以该空气合格,
=1.2×10-4mol,甲醛的质量为:1.2×10-4mol×30g/mol=3.6mg<0.08mg,所以该空气合格,故答案为:3.6;是.
分析:(1)高锰酸钾溶液具有强氧化性,能够氧化橡胶管;
(2)注射器压送气体速度过快,空气中甲醛没有完全被吸收;
(3)由于高锰酸钾溶液是紫红色溶液,不需要使用其他指示剂;当反应完毕,溶液中高锰酸钾溶液的紫红色会消失;
(4)先计算出总的高锰酸钾的物质的量,然后利用滴定数据计算出草酸消耗的高锰酸钾的物质的量,再计算出甲醛消耗高锰酸钾的物质的量,最后计算出1m3空气中含有的甲醛的质量,根据居室中甲醛含量标准,判断出空气质量情况.
点评:本题考查了空气中甲醛含量测定,根据反应的化学方程式,计算室内空气中甲醛含量,并与标准进行对照,判断室内甲醛是否超过标准,本题难度中等.

练习册系列答案
相关题目
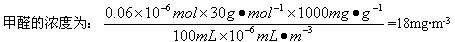

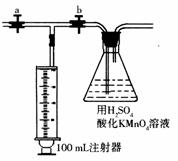 测定装置:部分装置如右图所示(a、b为止水夹)。
测定装置:部分装置如右图所示(a、b为止水夹)。