��Ŀ����
��ҵ������Ĺ��������÷�Ӧ2SO2��g����O2��g�� 2SO3��g������H<0����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
2SO3��g������H<0����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
��1��һ�������£���һ���������ܱ������г���2 mol SO2��1mol O2������Ӧ��������˵����ȷ���� ��
A������Ӧ����v (SO2) ��v (SO3)�������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
B�������¶Ⱥ�����������䣬����2 mol N2����ѧ��Ӧ���ʼӿ�
C��ƽ��������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�����Ӧ���ת����һ��������
D��ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ�������
E��ƽ��������¶ȣ�ƽ�ⳣ��K����
F�������¶Ⱥ�����������䣬ƽ����ٳ���2molSO3���ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�
��2����һ������SO2��g����O2��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
��ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ��v��SO2����ʾ�ķ�Ӧ����Ϊ �� ����y �� ��
��T1 T2 ,(ѡ�>������<����="��)," ʵ��2�д�ƽ��ʱ O2��ת����Ϊ ��
��3��β��SO2��NaOH��Һ���պ������Na2SO3�����г�����0.1 mol/L Na2SO3��Һ��ʵ��ⶨ��pHԼΪ8������������⣺
�� ����Һ��c(Na+)�� c(OH��)֮��Ϊ ��
�� ����Һ��c(OH-)= c(H+)+ + ������Һ����������Ũ�ȱ�ʾ����
�� �������Һ�м�������NaOH����ʱ��c(SO32��) , ˮ�����ӻ�Kw ����ѡ���������С�����䡱��
��4������ú������ʵ������ʵ����и���Һ�ֱ�������SO2���������������ɶൽ�ٵ�˳���� ��
A�� Na2CO3 B�� Ba(NO3)2 C��Na2S D������KMnO4
��1��D F����2���� 0.2 mol�� L-1�� min-1�� 0.2 mol �� >�� 90��
��3���� 2��105 �� �� c(HSO3-)+2c(H2SO3) ������ ���� ��4��B��C = D��A ��
���������������1��A��û����ȷv����v������Ӧ����v (SO2) ��v (SO3)������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬������B�������¶Ⱥ�����������䣬����2 mol N2��SO2��SO3��O2Ũ�Ȳ��䣬��ѧ��Ӧ���ʲ��䣬����C��ƽ��������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�������Ӧ���ת���ʲ�һ����������D���÷�Ӧ����Ϊ���������С�ķ�Ӧ��ƽ����ƶ�����ѹ�����壬ƽ�������ƶ���ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ���������ȷ��E���÷�ӦΪ���ȷ�Ӧ��ƽ��������¶ȣ�ƽ�������ƶ���ƽ�ⳣ��K��С������F�������¶Ⱥ�����������䣬ƽ����ٳ���2molSO3��ƽ�������ƶ����ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ���ȷ��ѡDF����2���ٸ���������ݷ�����ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱO2�����ʵ����仯Ϊ1.2mol�����ݷ�Ӧ����ʽȷ��SO2�����ʵ����仯Ϊ2.4mol�����ݹ�ʽv=��n/��tV���㣬v��SO2����ʾ�ķ�Ӧ����Ϊ0.2 mol�� L-1�� min-1������������ݷ�����ʵ��2�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱSO2�����ʵ����仯Ϊ3.6mol�����ݷ�Ӧ����ʽȷ��O2�����ʵ����仯Ϊ1.8mol����ƽ��ʱO2�����ʵ���Ϊ0.2mol������y��0.2mol���ڸ���������ݷ������¶���T1��ΪT2,ƽ�������ƶ����÷�ӦΪ���ȷ�Ӧ�������¶ȶԻ�ѧƽ���Ӱ������жϣ��ı������Ϊ���£���T1>T2 , ����������ݷ�����ʵ��2�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱSO2�����ʵ����仯Ϊ3.6mol�����ݷ�Ӧ����ʽȷ��O2�����ʵ����仯Ϊ1.8mol����ʵ��2�д�ƽ��ʱ O2��ת����Ϊ90������3���ٳ�����0.1 mol/L Na2SO3��Һ��c(Na+)=0.2mol/L��ʵ��ⶨ��pHԼΪ8��c(OH��)=10��6 mol/L������Һ��c(Na+)�� c(OH��)֮��Ϊ2��105���� ���������غ㣬����Һ��c(OH-)= c(H+)+c(HSO3-)+2c(H2SO3)���� ������0.1 mol/L Na2SO3��Һ����ˮ��ƽ�⣺SO32- + H2O  HSO3- + OH-,�������Һ�м�������NaOH����ʱ��������Ũ������ƽ�������ƶ���c(SO32��)�����¶Ȳ��䣬ˮ�����ӻ�Kw���䣻��4������������ʵ���Ϊ1mol��A�����ݻ�ѧ����ʽ2SO2+Na2CO3+H2O=2NaHSO3 +CO2�жϣ�1molNa2CO3�������2molSO2��B�� ���ݻ�ѧ����ʽBa(NO3)2 +3SO2+2H2O=BaSO4+2H2SO 4�жϣ�1molBa(NO3)2 �������3molSO2��C�����ݻ�ѧ����ʽ2Na2S+SO2 +2H2O=3S+4NaOH��SO2 +NaOH=NaHSO3�жϣ�1molNa2S�������2.5molSO2��D�����ݵ����غ��жϣ�1molKMnO4�������2.5molSO2���������������ɶൽ�ٵ�˳����B��C = D��A ��
HSO3- + OH-,�������Һ�м�������NaOH����ʱ��������Ũ������ƽ�������ƶ���c(SO32��)�����¶Ȳ��䣬ˮ�����ӻ�Kw���䣻��4������������ʵ���Ϊ1mol��A�����ݻ�ѧ����ʽ2SO2+Na2CO3+H2O=2NaHSO3 +CO2�жϣ�1molNa2CO3�������2molSO2��B�� ���ݻ�ѧ����ʽBa(NO3)2 +3SO2+2H2O=BaSO4+2H2SO 4�жϣ�1molBa(NO3)2 �������3molSO2��C�����ݻ�ѧ����ʽ2Na2S+SO2 +2H2O=3S+4NaOH��SO2 +NaOH=NaHSO3�жϣ�1molNa2S�������2.5molSO2��D�����ݵ����غ��жϣ�1molKMnO4�������2.5molSO2���������������ɶൽ�ٵ�˳����B��C = D��A ��
���㣺���黯ѧ��Ӧ���ʺͻ�ѧƽ�⡢�������Һ�����ݻ�ѧ����ʽ���㡣

�輰�仯����������ִ������ķ�չ��������ס���ش������й����⣺
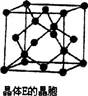
(1)��ԭ�ӵĽṹʾ��ͼ��________��
(2)������Ʒ���豸���õIJ������ڹ����ε���________��
�ٳ�����Ͽˮ���ӡ���ʯӢ���ά�����մ�����
����ͨ�������ݹ�̫���ܵ��
| A���٢ڢ� | B���ۢܢ� | C���ڢۢ� | D���٢ۢ� |
��Ԫ���ж��ֻ��ϼۣ����γɶ��ֻ����
��1����������1 mol��L��1 100 mL NaOH��Һǡ����ȫ����0.1 mol SO2���壬�˷�Ӧ�����ӷ���ʽΪ ������ҺpH_______7(�=����>������)��
��2��ijͬѧ�ڳ������������ʵ������̽��Na2S2O3�Ļ�ѧ���ʡ�
ʵ��ٿ�˵��________(����ĸ)
| A����Na2S2O3��Һ��ˮ�����c(OH��)=10��8mol/L |
| B��H2S2O3��һ������ |
| C��Na2S2O3��һ��������� |
| D��Na2S2O3ˮ�ⷽ��ʽΪS2O32��+2H2O=H2S2O3+2OH�� |
��3��ʵ�����Ƶõ�Na2S2O3�־��������������������ʡ�Ϊ�˲ⶨ�ֲ�Ʒ��Na2S2O3��5H2O(Ħ������Ϊ248g/mol)�ĺ�����һ�������������������KMnO4��Һ�ζ��ķ���(�ٶ��ֲ�Ʒ������������KMnO4��Һ����Ӧ)����ȡ1.28 g�Ĵ���Ʒ����ˮ����0.40mol/L KMnO4��Һ(�������������ữ)�ζ�������Һ��S2O32��ȫ��������ʱ������KMnO4��Һ���20.00 mL��(��֪��5S2O32��+8MnO4��+14H+=8Mn2++10SO42��+7H2O)��
�Իش�
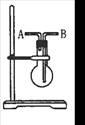
��KMnO4��Һ���ڡ���(���ʽ����ʽ��)�ζ����У��ζ��յ������Ϊ ��
�����ζ�ʱ����֣��տ�����Һ�ֲ���ɫ��ֹͣ�ζ������ʹ��Ʒ��Na2S2O3��5H2O�����������IJ������_____________(�ƫ�ߡ���ƫ�͡����䡱)��
�۲�Ʒ��Na2S2O3��5H2O����������Ϊ ��
 C
C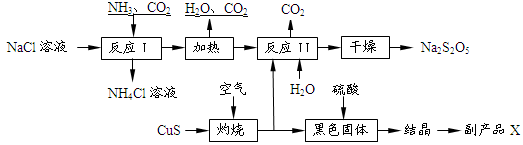
 Na2S2O5��H2O�ȶಽ��Ӧ��
Na2S2O5��H2O�ȶಽ��Ӧ��