题目内容
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17 g重甲基(-14CD3)所含的中子数为11NA;
②常温常压下,22.4 L NO气体的分子数小于NA;
③64 g铜发生氧化还原反应,一定失去2NA个电子;
④室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA;
⑤1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3 NA;
⑥常温常压下,1 mol氦气含有的核外电子数为4NA;
⑦6.8g熔融的KHSO4中含有的阳离子数为0.05 NA;
| A.①② | B.③④⑦ | C.②④⑦ | D.②⑤⑥ |
C
解析试题分析:①重甲基(-14CD3式量是20.17 g重甲基(-14CD3)的物质的量是17g/20(g/mol)所含的中子数为(20/17)×11<NA错误。②常温常压下,22.4 L NO气体的物质的量小于1mol。所以它的分子数小于NA。正确。③铜是变价金属。有+1、+2两种化合价。64 g铜发生氧化还原反应,若遇到强氧化剂失去2NA个电子;遇到弱氧化剂失去NA个电子。错误。④烯烃的分子式通式是CnH2n,最简式是CH2,式量是14.21.0g乙烯和丁烯的混合气体中含有的最简式的物质的量为21g÷14g/mol=1.5mol.所以含有的碳原子数目为1.5NA。正确。⑤1 mol铁足量稀盐酸反应时,转移电子数是2 NA;1 mol铝足量稀盐酸反应时,转移电子数是3 NA.所以1 mol铁铝混合物与足量稀盐酸反应时,转移电子数比3 NA少比 2 NA;多。错误。⑥氦是单原子分子,1 mol氦气含有的核外电子数为2NA。错误。⑦在熔融时KHSO4的电离方程式是:KHSO4=K++H++SO42-.1mol产生2mol阳离子。6.8gKHSO4的物质的量是6.8g÷136g/mol="0.05mol.sy" 中含有的阳离子数为0.05 NA;正确。选项为:C
考点:考查物质的量的应该计算的知识。

正确掌握化学用语和化学基本概念是学好化学的基础,下列有关表述中正确的一项是( )
| A.蔗糖与醋酸的最简式相同 |
| B.16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体 |
C.SiH4、CH4、 粒子的空间构型为正四面体型;CO2、C2H2均为直线型分子 粒子的空间构型为正四面体型;CO2、C2H2均为直线型分子 |
D.Ca2+的结构示意图为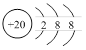 ;NH4Cl的电子式为 ;NH4Cl的电子式为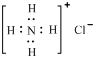 |
下列有关化学用语表示正确的是 ( )
| A.HClO的结构式:H-Cl-O |
B.N2的电子式: |
C.S2—的结构示意图: |
D.间羟基苯甲酸的结构简式: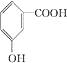 |
传统的引爆炸药由于其中含Pb,使用时将产生污染,同时其引爆后的剩余炸药还严重危害接触者的人身安全,美国UNC化学教授Thomas J.Meyer等研发了环境友好、 安全型的“绿色”引爆炸药,其中一种可表示为Na2R,爆炸后不会产生危害性残留物。已知10 mL Na2R溶液含Na+的微粒数为N个,该Na2R溶液的物质的量浓度为
| A.N×10-2 mol/L | B.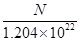 mol/L mol/L |
C. mol/L mol/L | D. mol/L mol/L |
下列关于叙述正确的是
| A.物质的量是含有一定数目粒子的集合体 |
| B.摩尔质量就是该物质的相对分子质量或相对原子质量 |
| C.单位物质的量的物质所占的体积就是气体摩尔体积 |
| D.40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1 mol/L |
下列溶液中的Cl-物质的量与100ml 1 mol·L-1AlCl3溶液中Cl-相等的是
| A.150ml 1 mol·L-1氯化钠溶液 | B.75ml 2 mol·L-1氯化镁溶液 |
| C.50ml 3mol·L-1氯化钾溶液 | D.50ml 1 mol·L-1氯化铁溶液 |
某同学按下图所示的步骤配制50mL 一定物质的量浓度的NaOH溶液,其中不正确的操作有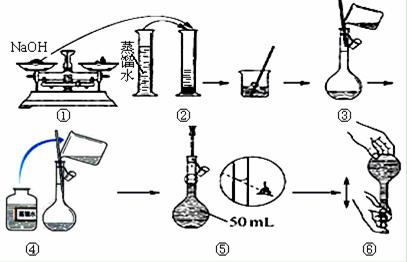

| A.②⑤ | B.①②⑤ | C.①②③⑤ | D.①②③④⑤ |
一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述不正确的是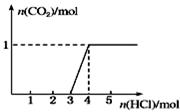
| A.通入的CO2气体在标准状况下的体积约为22.4 L |
| B.原溶液中c(NaOH)=2mol/L |
| C.A溶液中含Na2CO3和NaHCO3各1mol |
| D.A溶液中含有2molNaOH和1mol Na2CO3 |
下列有关化学用语表示正确的是( )
A.CCl4的比例模型: |
B.对甲基苯酚的结构简式: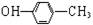 |
| C.乙醛的结构简式:C2H4O |
D.乙醇分子的比例模型: |