题目内容
10.金属钠用小刀切开后切面呈银白色,在空气中燃烧,火焰呈黄色,其生成物中氧元素的价态为-1,其化学方程式可表示为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2.分析 钠的化学性质很活泼,易与空气中的氧气和水蒸气反应,因此保存在煤油中,用小刀切,断面为银白色,具有金属光泽,很快被氧化而变暗,生成氧化钠.
解答 解:金属钠用小刀切开后切面呈银白色,在空气中燃烧,火焰呈黄色,其生成物过氧化钠中氧元素的价态为-1价,化学方程式为:2Na+O2 $\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
故答案为:银白色;-1;2Na+O2 $\frac{\underline{\;\;△\;\;}}{\;}$Na2O2.
点评 本题考查钠的化学性质,把握钠与氧气反应产物及金属的通性为解答的关键,注重基础知识的考查,题目较简单.

练习册系列答案
相关题目
1.下列化学用语表示错误的是( )
| A. | F-的结构示意图: | |
| B. | NaCl的电子式: | |
| C. | 8个中子的碳原子的核素符号:${\;}_{6}^{14}$C | |
| D. | CO2的结构式:O=C=O |
18.常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述中正确的是( )
①X被氧化;
②X是氧化剂;
③Y2+既具有氧化性也具有还原性;
④Y2+是氧化产物;
⑤Y3+的氧化性比X2+的氧化性强.
①X被氧化;
②X是氧化剂;
③Y2+既具有氧化性也具有还原性;
④Y2+是氧化产物;
⑤Y3+的氧化性比X2+的氧化性强.
| A. | ①②⑤ | B. | ①③⑤ | C. | ②④⑤ | D. | ③④⑤ |
5.向a mL 18mol•L-1的浓硫酸中加入足量铜片,并加热,被还原的H2SO4的物质的量和起酸性作用的H2SO4的物质的量分别为( )
| A. | 大于9a×10-3mol,小于18a×10-3mol | B. | 都等于9a×10-3mol | ||
| C. | 都等于18a×10-3mol | D. | 都小于9a×10-3mol |
15.一定温度下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=5的H2S溶液中,c(H+)═c(HS-)=1×10-5mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | 0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
2.下列反应不能发生的是( )
| A. | 盐酸+氢氧化钠溶液 | B. | 氯化钠溶液+硫酸钾溶液 | ||
| C. | 硝酸钙溶液+碳酸钠溶液 | D. | 稀硫酸+碳酸钠溶液 |
19.下列说法正确的是( )
| A. | 非金属单质中一定含有非极性共价键 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 氢键也是一种作用力很强的化学键 |
20.在有机合成中,合成高分子的单体或中间体是非常关键的环节.以下是制备甲、乙两种高分子单体原料的合成路线:

已知:
i. $→_{AlCl_{2}}^{RCl}$
$→_{AlCl_{2}}^{RCl}$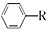
ii. $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
iii.R1CH=CHR2$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+R2CHO
iv 1mol B经过上述反应生成2mol C,C不能发生银镜反应.
请回答下列问题:
(1)A的结构简式为 .
.
(2)E→F的反应类型是还原反应.
(3)丙中官能团的名称是羧基、肽键.
(4)下列相关说法中正确的是bc(选填字母序号).
a.B存在顺反异构体
b.甲分子中最多有19个原子共面
c.化合物乙的合成过程中,F→G步骤是为了保护氨基
d.1mol H最多可以和3mol NaOH反应
(5)写出符合下列条件的E的同分异构体的结构简式 .
.
Ⅰ.红外光谱检测表明分子中含有-COOH和-NH2结构;
Ⅱ.1HNMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子.
(6)写出下列反应的化学方程式:
①A→B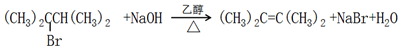 .
.
②由单体乙合成高分子化合物 .
.
(7)大量实验事实表明,当一些基团处于苯环上时,再引入的基团连接位置将受其影响,这种作用称为定位效应.已知一些基团的定位效应如右表.物质丁是乙的一种异构体,其结构差异是苯环上溴原子的位置不同.请以甲苯为起始原料,结合表给信息选用必要的无机试剂合成丁,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).

已知:
i.
 $→_{AlCl_{2}}^{RCl}$
$→_{AlCl_{2}}^{RCl}$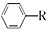
ii.
 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
iii.R1CH=CHR2$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+R2CHO
iv 1mol B经过上述反应生成2mol C,C不能发生银镜反应.
请回答下列问题:
(1)A的结构简式为
 .
.(2)E→F的反应类型是还原反应.
(3)丙中官能团的名称是羧基、肽键.
(4)下列相关说法中正确的是bc(选填字母序号).
a.B存在顺反异构体
b.甲分子中最多有19个原子共面
c.化合物乙的合成过程中,F→G步骤是为了保护氨基
d.1mol H最多可以和3mol NaOH反应
(5)写出符合下列条件的E的同分异构体的结构简式
 .
.Ⅰ.红外光谱检测表明分子中含有-COOH和-NH2结构;
Ⅱ.1HNMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子.
(6)写出下列反应的化学方程式:
①A→B
 .
.②由单体乙合成高分子化合物
 .
.| 邻对位 定位基 | -CH3、-X、 -NH2、-NHCOR |
| 间位定位基 | -NO2,-COOH |