题目内容
【题目】A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②![]() 、
、![]() 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答:
(1)HmDm的结构式___________________。
(2)![]() 、
、![]() 的还原性强的为:_________,能证明其还原性强弱的离子方程式为_______。
的还原性强的为:_________,能证明其还原性强弱的离子方程式为_______。
(3)将E的单质通入A与D形成的化合物的水溶液中,其化学方程式为:_________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的化学方程式__________________________________。在该溶液中溶质中含有的化学键类型是____________。
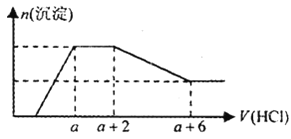
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
![]()
【答案】 ![]() S2- Cl2 + S2-= 2Cl-+ S↓ Cl2 + 2NaOH= NaCl+ NaClO+ H2O H2 S+ NaOH= NaHS+ H2O 离子键和共价键 Na、S
S2- Cl2 + S2-= 2Cl-+ S↓ Cl2 + 2NaOH= NaCl+ NaClO+ H2O H2 S+ NaOH= NaHS+ H2O 离子键和共价键 Na、S
【解析】短周期元素中,A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,则A处于IA族,B的氧化物既可以与强酸反应,又可以与强碱反应,则B为Al、A为Na;A与B质子数之和是D质子数的3倍,则D的质子数为(11+13)/3=8,故D为O元素;由①热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据②Cm-、E(m-1)-具有相同的电子层结构,所以E为Cl元素,则
(1)由上述分析可知,HmDm是双氧水,结构式为H-O-O-H;(2)元素的非金属性越强,其简单阴离子的还原性越弱,S元素的非金属性小于Cl元素,所以还原性强弱顺序为S2->Cl-,氯气能氧化硫离子生成硫单质,反应方程式为Cl2 + S2-=2Cl-+ S↓;(3)E是氯气,A与D形成的化合物的水溶液是NaOH,二者反应的化学方程式为Cl2 + 2NaOH= NaCl+ NaClO+ H2O;(4)常温下,将等物质的量浓度的H2S溶液和A的最高价氧化物对应的水化物氢氧化钠溶液等体积混合生成NaHS,该反应的化学方程式为H2S+ NaOH= NaHS+ H2O。NaHS中含有的化学键类型是离子键和共价键;(5)A、B、C、E单质分别是Na、Al、S、Cl2,根据单质能连续被氧气氧化,其氧化物2能与水反应生成,符合条件的是Na和S。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案