题目内容
1999年中国十大科技进展中的其中一项为:储氢碳纳米管研究获重大进展,用电弧法合成碳纳米管,常伴有大量杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化汽化法提纯.其反应式为:K2Cr2O7+C+H2SO4→Cr2(SO4)3+K2SO4+H2O+CO2↑(1)配平上述反应的化学方程式,并用单线桥法表示出电子转移.
(2)此反应的氧化剂为
(3)要使10mL 1.0mol?L-1的K2Cr2O7溶液被还原,至少要加入
(4)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(5)在配平H2O2、KMnO4、H2SO4三者反应的化学方程式时,出现多套配平系数,如:
a.7H2O2+2KMnO4+3H2SO4=2MnSO4+6O2↑+K2SO4+10H2O
b.5H2O2+2KMnO4+3H2SO4=2MnSO4+5O2↑+K2SO4+8H2O
c.9H2O2+2KMnO4+3H2SO4=2MnSO4+7O2↑+K2SO4+12H2O
用H218O2进行示踪实验(18O为示踪原子),证实生成的氧气全部是18O2,仅据这一实验事实,回答下列问题:
①H2O2仅起还原剂作用的化学方程式是
②研究三个化学方程式各组系数的变化规律,写出符合该规律的一个新的化学方程式
分析:(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,结合质量守恒定律进行配平;
(2)根据反应中元素的化合价的变化来判断氧化剂以及被氧化的元素;
(3)根据重铬酸钾的物质的量及反应方程式计算出需要硫酸溶液的体积;
(4)根据硫酸在反应的化合价是否发生变化来判断硫酸在反应中表现出来的性质;
(5)a.7H2O2+2KMnO4+3H2SO4═2MnSO4+6O2↑+K2SO4+10H2O中,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
b.5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O,Mn元素的化合价降低,H2O2中O元素化合价升高;
c.9H2O2+2KMnO4+3H2SO4═2MnSO4+7O2↑+K2SO4+12H2O,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
①H2O2仅作还原剂,其O元素的化合价只升高;
②由化学计量数的变化可知,H2O2的系数增加2,则生成的氧气系数增加1,生成水的系数增加2,以此解答.
(2)根据反应中元素的化合价的变化来判断氧化剂以及被氧化的元素;
(3)根据重铬酸钾的物质的量及反应方程式计算出需要硫酸溶液的体积;
(4)根据硫酸在反应的化合价是否发生变化来判断硫酸在反应中表现出来的性质;
(5)a.7H2O2+2KMnO4+3H2SO4═2MnSO4+6O2↑+K2SO4+10H2O中,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
b.5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O,Mn元素的化合价降低,H2O2中O元素化合价升高;
c.9H2O2+2KMnO4+3H2SO4═2MnSO4+7O2↑+K2SO4+12H2O,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
①H2O2仅作还原剂,其O元素的化合价只升高;
②由化学计量数的变化可知,H2O2的系数增加2,则生成的氧气系数增加1,生成水的系数增加2,以此解答.
解答:解:(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,由电子守恒可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由质量守恒定律可知,配平后的化学反应为:2K2Cr2O7+3C+8H2SO4=2K2SO4+2Cr2(SO4)3+8H2O+3CO2;反应中C元素的化合价由0升高为+4价,3个C转移电子数为12e-,用单线桥法表示出电子转移为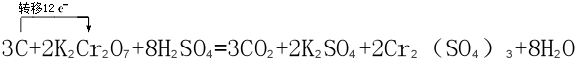 ;
;
故答案为:2,3,8,2,2,8,3;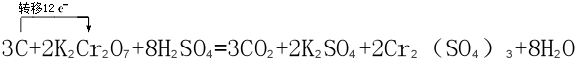 ;
;
(2)分析所给物质的化合价氧化剂为K2Cr2O7,还原产物为Cr2(SO4)3,还原剂为C,氧化产物为CO2,
故答案为:K2Cr2O7;CO2;
(3)10mL 1.0mol?L-1的K2Cr2O7溶液中含有K2Cr2O7的物质的量为:1.0mol?L-1×0.01L=0.01mol,根据反应方程式2K2Cr2O7+3C+8H2SO4=2K2SO4+2Cr2(SO4)3+8H2O+3CO2可知,消耗硫酸的物质的量为0.04mol,需要2.0mol?L-1的H2SO4溶液的体积为:V=
=0.02L=20mL,
故答案为:20;
(4)H2SO4在反应中各元素的化合价没有发生变化,只表现酸性,故答案为:A;
(5)a.7H2O2+2KMnO4+3H2SO4═2MnSO4+6O2↑+K2SO4+10H2O中,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
b.5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O,Mn元素的化合价降低,H2O2中O元素化合价升高;
c.9H2O2+2KMnO4+3H2SO4═2MnSO4+7O2↑+K2SO4+12H2O,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
①H2O2仅作还原剂,其O元素的化合价只升高,2molKMnO4得到10mol电子,则只有b符合只作还原剂遵循电子守恒,故答案为:b;
②由化学计量数的变化可知,H2O2的系数增加2,则生成的氧气系数增加1,生成水的系数增加2,符合条件的反应为:11H2O2+2KMnO4+3H2SO4═2MnSO4+8O2↑+K2SO4+14H2O,故答案为:11H2O2+2KMnO4+3H2SO4═2MnSO4+8O2↑+K2SO4+14H2O.
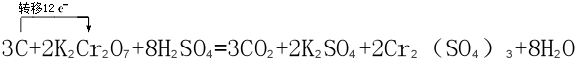 ;
;故答案为:2,3,8,2,2,8,3;
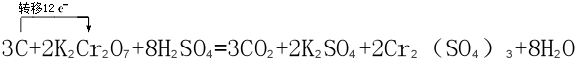 ;
;(2)分析所给物质的化合价氧化剂为K2Cr2O7,还原产物为Cr2(SO4)3,还原剂为C,氧化产物为CO2,
故答案为:K2Cr2O7;CO2;
(3)10mL 1.0mol?L-1的K2Cr2O7溶液中含有K2Cr2O7的物质的量为:1.0mol?L-1×0.01L=0.01mol,根据反应方程式2K2Cr2O7+3C+8H2SO4=2K2SO4+2Cr2(SO4)3+8H2O+3CO2可知,消耗硫酸的物质的量为0.04mol,需要2.0mol?L-1的H2SO4溶液的体积为:V=
| 0.04mol |
| 2.0mol/L |
故答案为:20;
(4)H2SO4在反应中各元素的化合价没有发生变化,只表现酸性,故答案为:A;
(5)a.7H2O2+2KMnO4+3H2SO4═2MnSO4+6O2↑+K2SO4+10H2O中,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
b.5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O,Mn元素的化合价降低,H2O2中O元素化合价升高;
c.9H2O2+2KMnO4+3H2SO4═2MnSO4+7O2↑+K2SO4+12H2O,Mn元素的化合价降低,H2O2中O元素化合价升高也降低;
①H2O2仅作还原剂,其O元素的化合价只升高,2molKMnO4得到10mol电子,则只有b符合只作还原剂遵循电子守恒,故答案为:b;
②由化学计量数的变化可知,H2O2的系数增加2,则生成的氧气系数增加1,生成水的系数增加2,符合条件的反应为:11H2O2+2KMnO4+3H2SO4═2MnSO4+8O2↑+K2SO4+14H2O,故答案为:11H2O2+2KMnO4+3H2SO4═2MnSO4+8O2↑+K2SO4+14H2O.
点评:本题考查氧化还原反应方程式的配平,氧化剂、还原剂等概念的了解和判断,以及有关氧化还原反应的简单计算,做题时注意正确判断化合价的变化,从氧化还原反应氧化剂和还原剂得失电子数目相等进行配平和计算.

练习册系列答案
相关题目
2001年1月6日,我国525名两院院士投票评选出1999年中国十大科技进步奖,其中一项是:储氢碳纳米管研究获重大进展。电弧法合成的碳纳米管,常伴有大量杂质——纳米颗粒。这种碳纳米颗粒可用氧化汽化法提纯。 其反应式是3C+2 K2Cr2O7+ 8H2SO4 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
其反应式是3C+2 K2Cr2O7+ 8H2SO4 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
(1)单线法标出电子转移的数目和方向。
(2)此反应的氧化剂是 氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
 其反应式是3C+2 K2Cr2O7+ 8H2SO4
3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
其反应式是3C+2 K2Cr2O7+ 8H2SO4
3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O